Задание №1
Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют электронную конфигурацию внешнего энергетического уровня ns2np4.
Запишите в поле ответа номера выбранных элементов.
| Войдите, чтобы Ваши результаты сохранялись: |
Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют электронную конфигурацию внешнего энергетического уровня ns2np4.
Запишите в поле ответа номера выбранных элементов.
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке возрастания их атомных радиусов.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Из числа указанных в ряду элементов выберите два элемента, степень окисления которых в оксидах может принимать значение +3.
Запишите в поле ответа номера выбранных элементов.
Из предложенного перечня выберите два свойства, которые характеризуют вещества с молекулярной кристаллической решёткой.
Среди предложенных формул/названий веществ, расположенных в пронумерованных ячейках, выберите формулы/названия: А) средней соли; Б) основания; В) амфотерного оксида.
|
1 питьевая сода
|
2 Be(OH)2
|
3 CuCl2
|
|
4
Mg(H2PO4)2
|
5 гидроксид хрома(II)
|
6
BaO2
|
|
7 оксид фосфора(III)
|
8 Fe2O3
|
9 Zn(OH)2
|
Запишите в таблицу номера ячеек, в которых расположены выбранные вещества, под соответствующими буквами.
|
Даны две пробирки с раствором вещества X. В одну из них добавили раствор вещества Y, при этом протекала реакция, которой соответствует сокращённое ионное уравнение H+ + OH – = H2O. В другую пробирку добавили раствор хлорида магния. При этом наблюдали образование осадка.
Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
| 1) |
Fe(OH)2 |
| 2) |
Ba(OH)2 |
| 3) |
H2SO4 |
| 4) |
HNO3 |
| 5) |
NH3 |
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
|
|
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
|
Запишите в таблицу выбранные цифры под соответствующими буквами.
|
|
Установите соответствие между исходными веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
|
Запишите в таблицу выбранные цифры под соответствующими буквами.
|
Задана схема превращений веществ:
CO
Определите, какие из указанных веществ являются веществами X и Y.
| 1) |
Cu |
| 2) |
CuO |
| 3) |
Mg |
| 4) |
MgO |
| 5) |
NaOH |
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
|
|
Установите соответствие между формулой вещества и классом/группой соединений, к которому(-ой) оно принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
|
Запишите в таблицу выбранные цифры под соответствующими буквами.
|
Из предложенного перечня веществ выберите два вещества, которые являются межклассовыми изомерами.
Из предложенного перечня выберите все реакции, в результате которых образуется карбонильное соединение.
Из предложенного перечня выберите два вещества, каждое из которых вступает в реакцию с аминокислотой, формула которой
|
Установите соответствие между химической реакцией и органическим веществом, преимущественно образующимся в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
|
Запишите в таблицу выбранные цифры под соответствующими буквами.
|
|
Установите соответствие между химическим процессом и органическим веществом, которое является продуктом в этом процессе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
|
Запишите в таблицу выбранные цифры под соответствующими буквами.
|
Задана схема превращений веществ:
ацетальдегид → X
Определите, какие из указанных веществ являются веществами Х и Y.
| 1) |
уксусная кислота |
| 2) |
этанол |
| 3) |
хлорэтан |
| 4) |
этилен |
| 5) |
1,2-дихлорэтан |
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
|
Из предложенного перечня выберите все пáры веществ, взаимодействие которых является реакцией соединения.
Из предложенного перечня выберите все факторы, которые приводят к уменьшению скорости химической реакции бутана с кислородом.
|
Установите соответствие между схемой реакции и свойством меди, которое этот элемент проявляет в данной реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
|
Запишите в таблицу выбранные цифры под соответствующими буквами.
|
|
Установите соответствие между формулой вещества и продуктами электролиза его водного раствора, которые образуются на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
|
Запишите в таблицу выбранные цифры под соответствующими буквами.
|
|
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
|
| 1) |
Zn(NO3)2 |
| 2) |
CsOH |
| 3) |
CaBr2 |
| 4) |
K3PO4 |
Запишите номера веществ в порядке возрастания значения pH их водных растворов, учитывая, что концентрация веществ во всех растворах (моль/л) одинаковая.
|
Установите соответствие между способом воздействия на равновесную систему СOCl2(г) ⇔ СO(г) + Cl2(г) – Q и направлением смещения химического равновесия в результате этого воздействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
|
Запишите в таблицу выбранные цифры под соответствующими буквами.
|
|
В реактор постоянного объёма поместили оксид азота(I) и водород. При этом исходная концентрация водорода составляла 0,06 моль/л. В результате протекания обратимой реакции N2O(г) + 4H2(г) ⇄ 2NH3(г) + H2O(г) в реакционной системе установилось химическое равновесие, при котором концентрации оксида азота(I) и аммиака составили 0,02 моль/л и 0,01 моль/л соответственно. Определите исходную концентрацию оксида азота(I) (X) и равновесную концентрацию водорода (Y).
Выберите из списка номера правильных ответов: |
| 1) |
0,005 моль/л |
| 2) |
0,020 моль/л |
| 3) |
0,025 моль/л |
| 4) |
0,030 моль/л |
| 5) |
0,040 моль/л |
| 6) |
0,050 моль/л |
Запишите выбранные номера в таблицу под соответствующими буквами.
|
|
Установите соответствие между двумя веществами, взятыми в виде водных растворов, и реактивом, с помощью которого можно различить эти вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
|
Запишите в таблицу выбранные цифры под соответствующими буквами.
|
|
Установите соответствие между схемой превращения вещества и названием химического процесса, лежащего в основе этого превращения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. |
|
Запишите в таблицу выбранные цифры под соответствующими буквами.
|
Сколько граммов воды следует добавить к 600 г 10%-ного раствора нитрата аммония, чтобы массовая доля соли стала равной 3%? (Запишите число
с точностью до целых.)
Какой объём кислорода необходим для окисления 250 л оксида азота(II) в оксид азота(IV)? Объёмы газов измерены при одинаковых условиях. Выход продукта считать равным 100%.
(Запишите число с точностью до целых.)
При сплавлении гидроксида калия с техническим ацетатом калия массой 2,2 г образовался метан объемом (н.у.) 448 мл. Вычислите массовую долю примеси в ацетате калия.
(Запишите число с точностью до целых.)
Для выполнения заданий 29 и 30 используйте следующий перечень веществ: азотная кислота, гидроксид железа(II), хлорат калия, ацетат серебра, оксид хрома(III), сероводород. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с образованием соли и выделением бурого газа. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает без видимых признаков. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Фосфид алюминия растворили в соляной кислоте. К полученному при этом раствору добавили раствор сульфита калия и наблюдали образование белого осадка и выделение бесцветного газа. Полученный газ разделили на две части. Одну часть поглотили раствором дихромата натрия, подкисленным серной кислотой. Другую часть газа поглотили концентрированным раствором азотной кислоты.
Напишите уравнения четырёх описанных реакций.
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
бензоат натрия 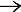 X1 C2H4, H3PO4 X2
X1 C2H4, H3PO4 X2 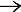 X3
X3 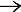 стирол KMnO4, H2SO4, t° X4
стирол KMnO4, H2SO4, t° X4
При написании уравнений реакций используйте структурные формулы органических веществ.
При сгорании 16,2 г органического вещества нециклического строения получили 26,88 л (н.у.) углекислого газа и 16,2 г воды. Известно, что 1 моль этого органического вещества в присутствии катализатора присоединяет только 1 моль воды и данное вещество не реагирует с аммиачным раствором оксида серебра.
На основании данных условия задачи:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу органического вещества;
3) составьте структурную формулу органического вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение реакции гидратации органического вещества.
Раствор нитрата меди(II) массой 2 кг 730 г с массовой долей нитрата меди(II) 18,8%, содержащий в качестве примеси нитрат серебра, разлили на две колбы в соотношении 1 : 2. В первую колбу, содержащую меньшую часть раствора, опустили медную проволоку. После завершения реакции проволоку извлекли из раствора. При этом массовая доля нитрата меди(II) в первой колбе составила 20%. (Возможной реакцией меди с нитратом меди(II) пренебречь.) В раствор во второй колбе внесли порошок цинка, в результате получили бесцветный раствор. Вычислите массовую долю соли в конечном растворе во второй колбе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).