№B0213EВпишите правильный ответ.
Задача №1
Препараты фтора являются эффективными средствами профилактики кариеса зубов. Монофторофосфат натрия – неорганическое соединение, соль натрия и фторфосфорной кислоты с формулой Na2PO3F – входит в состав зубных паст. В 150 г фторированной зубной пасты содержится 78 мг монофторофосфата натрия.
Определите массу (в миллиграммах) фтора, который содержится в тюбике зубной пасты массой 100 г. Запишите число с точностью до целых.
Решение:
В задаче сказано, что 150 г фторированной зубной пасты содержится 78 мг соединения Na2PO3F. Составим пропорцию и определим сколько миллиграммов этого соединения содержится в 100 гр пасты. Обозначим это число за x:
150 гр (пасты) ---- 78 мг (Na2PO3F)
100 гр (пасты) ---- x мг (Na2PO3F).
Решаем пропорцию:
x = 100·78/150 = 52 мг.
Т.е. m(Na2PO3F) = 52 мг.
Ранее в соответствующей задаче №18 (номера задач в уроках 51 и 52 совпадают) мы определили массовую долю фтора в соединении Na2PO3F: ω(F) = 13.2%.
Запишем общую формулу для расчета массовой доли (в долях), зная массу элемента и массу всего вещества:
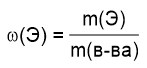
Массовая доля фтора известна (13,2%, но в расчетах используем доли, т.е. 0,132), масса всего вещества также известна (52 мг). Осталось выразить m(Э) и посчитать:
m(F) = ω(F)·m(Na2PO3F) = 0,132·52 = 6,86 мг. Округляем до целых и записываем ответ:
m(F) = 7 мг.
Ответ: 7
