Заметки из вебинаров
Каждый год составители ЕГЭ по химии проводят вебинары для учителей, в которых они рассказывают, что именно ожидают от учеников, сдававших ЕГЭ. На этой странице мы рассмотрим один из таких вебинаров, где Светлана Владленовна Стаханова подробно рассказывает о заданиях 29 и 30. Весь вебинар смотреть не нужно, так как он ориентирован на учителей, но есть и очень полезная информация для учеников, об этом здесь и пойдет речь. Вебинар был проведен в 2017 году, поэтому номера заданий другие - 30 и 31, но сама суть заданий не изменилась.
Потренироваться составлять реакции онлайн (в рамках ЕГЭ) можно тут.
Ссылка на видео на vk.com
Краткое содержание вебинара:
17:02 - начало обсуждения задания 29
19:07 - критерии оценивания
23:01 - важнейшие окислители и восстановители
25:43 - продукты реакций с HNO3
27:12 - примеры реакций с HNO3
30:08 - примеры реакций с H2SO4(конц.)
30:45 - реакции с KMnO4 и MnO2
31:57 - реакции хроматов и дихроматов в кислой среде
32:53 - кислородсодержащие соединения хлора
33:23 - продукты окисления важнейших восстановителей.
Некоторые важные моменты
1. На следующем слайде (время 23:01) показаны важнейшие окислители и восстановители, которые необходимо знать. К списку окислителей также можно добавить соединения Cu(II) и пероксиды щелочных металлов.

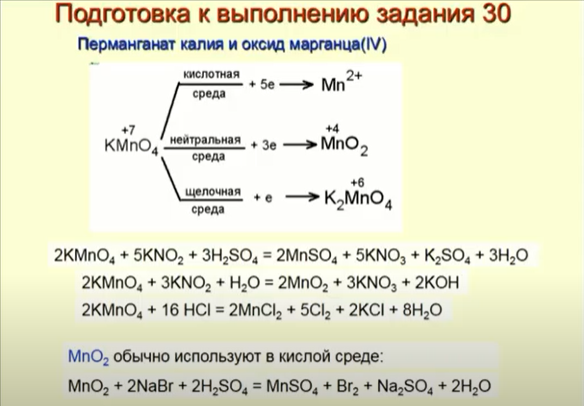
2. Продукты восстановления перманганата калия (или натрия) в зависимости от среды подробно изучаются в школьной программе, но вот про оксид марганца (IV) MnO2 часто забывают. Также важно, что этот оксид вступает в реакции только в кислой среде. В результате образуются соли соответствующих кислот.
3. Продукты реакций восстановления хроматов и дихроматов также зависят от среды, в которой протекает реакция. Составители экзамена рекомендуют (по возможности) писать реакции в кислой среде с образованием соли Cr(III), так как реакцию в щелочной среде с образованием гидроксокомплекса написать гораздо сложнее. Напомним, что согласно кодификатору ЕГЭ, на экзамене проверяются знания свойств гидроксокомплексов только на примере Al и Zn, т.е. реакций с образованием гидроксокомплексов хрома в заданиях быть не должно.

4. На следующем слайде (время 33:23) показаны продукты окисления важнейших восстановителей. Как можно видеть, продукты реакций легко запомнить - это простые вещества, за исключением соединений серы и фосфора.

5. На экзамене очень важно понимать разницу между степенью окисления элемента и зарядом иона. В задании 29 на ОВР везде нужно писать степени окисления (сначала знак, затем цифра), тогда как в задании 30 на реакции ионного обмена везде нужно писать заряды ионов (сначала цифра и затем знак). Нижний индекс в электронном балансе допускается, только если это простое вещество, например I2, Br2 и др.

6. В задании 30 на составление уравнения ионного обмена могут встречаться кислые соли и слабые кислоты (на примере H3PO4). На следующем слайде показано как правильно расписывать их на ионы.

В случае гидросульфата натрия диссоциация хорошо идет по двум ступеням, т.е. возможны две записи: NaHSO4 -> Na+ + HSO4– и NaHSO4 -> Na+ + H+ + SO42–.
В случае ортофосфорной кислоты возможны два варианта: либо оставить ее в молекулярном виде (т.е. вообще не расписывать на ионы), либо написать уравнение диссоциации по первой ступени: H3PO4 -> H+ + H2PO4–.
7. Также на экзамене могут встречаться реакции с образованием гидроксокомплексов Zn и Al. Как их нужно расписывать на ионы показано ниже.
Если в реакции образуется гидроксид аммония, записывать нужно как гидрат аммиака (NH3·H2O) или аммиак и воду (NH3 + H2O).

8. Существует несколько вариантов как записывать уравнения образования гидроксокомплексов алюминия: K[Al(OH)4], K[Al(OH)6] или K[Al(H2O)2(OH)4]. Любой из этих вариантов будет засчитан как правильный ответ.
В реакциях двойного гидролиза можно записывать как кислую, так и среднюю соль слабой кислоты.

