Заметки из вебинаров
В 2022 году в КИМ появляются два принципиально новых задания: расчетная задача на равновесие и задание на pH. Для того чтобы объяснить принципы выполнения этих заданий, а также показать объем знаний, необходимый для их успешного выполнения, в декабре 2021 года составителями ЕГЭ был проведен вебинар. На этом вебинаре Светлана Владленовна Стаханова подробно рассказала о том, что такое равновесие, привела по два примера задачи 23 с подробными решениями, а также детально и с примерами рассмотрела задание на pH.
Эти вебинары проводятся для учителей, поэтому полностью смотреть их не нужно. Ниже показано время обсуждения самых важных моментов для самостоятельного просмотра ученикам.
Ссылка на видео на vk.com
Краткое содержание вебинара:
1:36:00 - начало обсуждения задач на равновесие
1:36:30 - что такое равновесие
1:44:54 - пример решения задачи 23 (1)
1:48:04 - пример решения задачи 23 (2)
1:49:12 - задание 21, что такое pH
1:58:40 - какие соединения могут встретиться в задании
1:59:46 - пример решения задания 21 (1)
2:01:06 - пример решения задания 21 (2)
Некоторые важные моменты
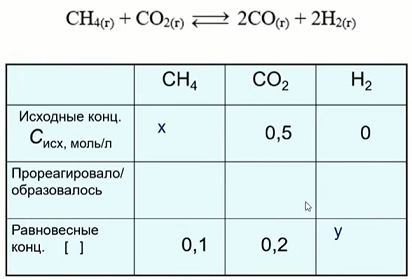
1. Равновесие в системе достигается, когда концентрации как реагентов, так и продуктов становятся постоянными, т.е. скорости прямой и обратной реакций становятся одинаковыми. На видео Светлана Владленовна подробно рассказала как решать задачи на равновесие (время 1:36:30). Здесь мы только приведем таблицу концентраций, использование которой сильно упрощает понимание и решение такого типа задач.
2. "pH - водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды". Интересно знать, что из миллиарда молекул воды только две диссоциируют на ионы H+ и OH–.
Концентрация ионов водорода в чистой воде равна 10–7, следовательно, pH такой воды равен 7. Если к раствору добавить кислоту, pH будет уменьшаться (среда раствора - кислая), если же добавить щелочь, pH будет увеличиваться (среда раствора - щелочная).

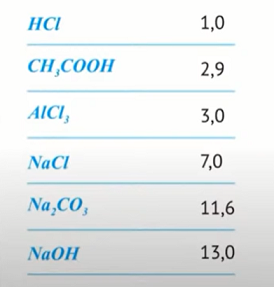
3. На следующем слайде показаны примеры значений pH различных соединений (время 1:56:10).
Первая кислота HCl является сильной, вторая CH3COOH - слабой. И как мы видим, чем сильнее кислота, тем меньше значение pH. Среда раствора - кислая.
Далее идет соль, образованная сильной кислотой (HCl) и слабым основанием (Al(OH)3). Такие соли в водном растворе гидролизуются по катиону, т.е. катион Al3+ взаимодействует с водой с образованием слабого электролита:
Al3+ + H2O -> AlOH2+ + H+ (первая ступень).
Как видно из уравнения, в растворе накапливаются ионы H+, т.е. раствор подкисляется. Значение pH становится меньше 7 (pH = 3.0), но и не такое низкое, как при растворе чистой кислоты (pH = 1.0).
Далее идет соль NaCl, соль сильной кислоты (HCl) и сильного основания (NaOH). Так ни ион Na+, ни ион Cl– не взаимодействуют с водой, слабых электролитов не образуется, и среда раствора не изменяется (остается как и прежде равной 7, т.е. pH воды).
Следующей идет соль Na2CO3, соль слабой кислоты (H2CO3) и сильного основания (NaOH). В этом случае ион CO32– реагирует с водой, образуя слабый электролит. Уравнение гидролиза по аниону (по первой ступени) выглядит следующим образом:
CO32– + H2O -> HCO3– + OH–.
И снова, из уравнения видим, что в растворе накапливаются ионы OH–, т.е. среда раствора становится слабо щелочной.
И последним в этом списке соединений стоит NaOH, сильное основание. Так как в растворе в значительной количестве присутствуют гидроксид-ионы, среда раствора - щелочная.
В следующей таблице показаны значения pH растворов некоторых кислот, солей и щелочей с концентрацией 0,1 моль/л.
4. На видео Светлана Владленовна перечислила все вещества, которые могут встретиться в этом задании (1:58:53), а именно:
Щелочь (pH>7),
Кислота сильная (ph<7, среда сильно кислая),
Кислота слабая (pH<7, среда кислая),
Соль, гидролизующаяся по катиону (ph<7, среда слабо кислая),
Соль, гидролизующаяся по аниону (ph>7, среда слабо щелочная),
Соль, которая не подвергается гидролизу (pH=7, среда нейтральная),
Кислая соль (только гидрокарбонаты, pH>7, среда слабо щелочная).
Все вышесказанные рассуждения можно обобщить следующей схемой, в которой показано увеличение значения pH всех возможных соединений, перечисленных выше:
Сильная кислота -> слабая кислота -> соль, образованная сильной кислотой и слабым основанием -> соль, образованная сильной кислотой и сильным основанием -> соль, образованная слабой кислотой и сильным основанием -> щелочь.
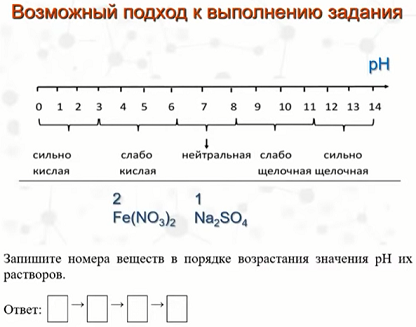
5. На следующем слайде пояснение вопроса о кислых солях, как правильно их расписывать на ионы в ионных уравнениях.

6. При взаимодействии кислых солей с гидроксидами реакции могут быть записаны несколькими способами. Все варианты будут засчитаны верными.

Другие примеры:
3Mg(H2PO4)2 + 12KOH -> Mg3(PO4)2↓ + 4K3PO4 + 12H2O или
Mg(H2PO4)2 + 6KOH -> Mg(OH)2↓ + 2K3PO4 + 4H2O.
2KHCO3 + Ba(OH)2 -> BaCO3↓ + K2CO3 + 2H2O или
KHCO3 + Ba(OH)2(изб.) -> BaCO3↓ + KOH + H2O
3NaH2PO4 + 3Ba(OH)2 → Ba3(PO4)2↓ + Na3PO4 + 6H2O или
3Ba(OH)2 + 2NaH2PO4 → Ba3(PO4)2↓ + 2NaOH + 4H2O
