Строение электронной оболочки атома
Атом состоит из ядра и электронной оболочки.
Электронная оболочка атома - это совокупность всех электронов в данном атоме.
В рамках ОГЭ изучается строение электронных оболочек атомов первых 20 химических элементов Периодической системы Д.И. Менделеева, т.е. до 20Ca включительно.
Атомная орбиталь - часть атомного пространства, в которой вероятность нахождения данного электрона наибольшая. Можно говорить только о вероятности нахождения электрона в разных частях атомного пространства, а не о его траектории движения.
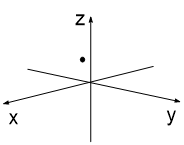
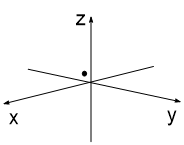
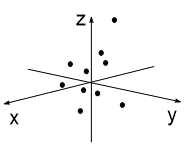
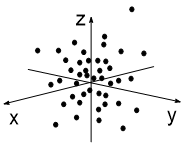
Представим, что мы (каким-то образом) сфотографировали атом с одним электроном 3 раза. Каждый раз этот электрон окажется в разных точках атомного пространства (рис. 1-3). Далее совместим 10 таких снимков в одном (рис 4), 50 снимков (рис. 5) и 100 снимков (рис. 6). В итоге получим изображение атомной s-орбитали, которая имеет форму шара, т.е. в данной части пространства нахождение электрона наиболее вероятно.
 |
 |
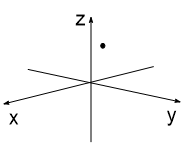 |
| Рис. 1 | Рис. 2 | Рис. 3 |
 |
 |
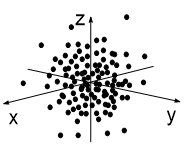 |
| Рис. 4 | Рис. 5 | Рис. 6 |
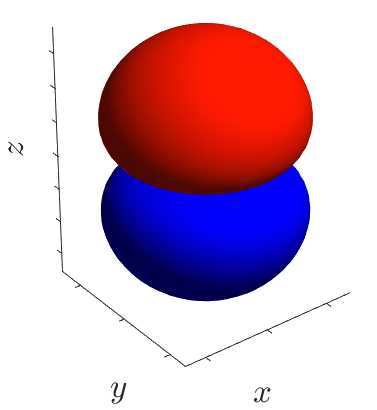
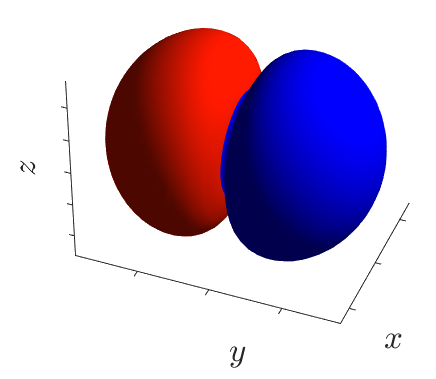
Каждая атомная орбиталь имеет определённую форму, орбитали разной симметрии обозначают буквами s, p, d и f. На следующем рисунке представлены формы орбиталей s, p (построены в программе Matlab). Распределение электронов по d- и f-орбиталям изучается в 11 классе.
| s-орбиталь | 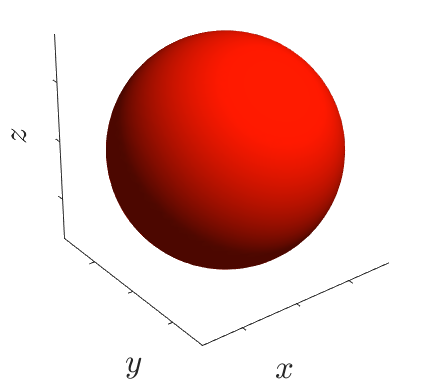 |
||
| p-орбитали | 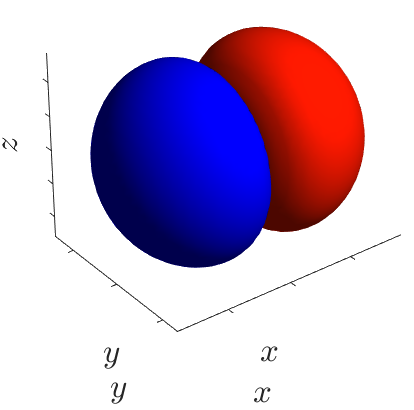 |
 |
 |
Энергия и размер орбитали характеризуются главным квантовым числом n, которое принимает значение целых чисел от 1 до бесконечности:
n = 1, 2, 3, 4, 5, и т.д. Этим числом n обозначают энергетические уровни, на которых находятся электроны.
Энергетический уровень - совокупность орбиталей, которые имеют одинаковое значение главного квантового числа.
Каждый энергетический уровень состоит из n подуровней.
Энергетический подуровень - это совокупность орбиталей, которые находятся на одном энергетическом уровне, он объединяет орбитали одного вида. Например, s-подуровень (одна s-орбиталь), p-подуровень (на нём находятся три p-орбитали: px, py и pz). Орбитали s- и p-подуровней показаны на рисунке выше.
Графически любая орбиталь изображается в виде клетки:  . На одной орбитали максимум может находиться два электрона, их называют спаренными или неподелённой электронной парой. Если электрон на орбитали один, его называют неспаренным.
. На одной орбитали максимум может находиться два электрона, их называют спаренными или неподелённой электронной парой. Если электрон на орбитали один, его называют неспаренным.
Покажем подуровни графически (для ОГЭ необходимы только s- и p-подуровни):
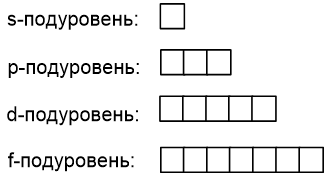
Согласно данной схеме, s-подуровень состоит из одной s-орбитали, p-подуровень состоит из трёх p-орбиталей и т.д:
| Подуровень | Число орбиталей | Максимальное число электронов на подуровне |
|---|---|---|
| s | 1  |
2 |
| p | 3 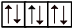 |
6 |
Число подуровней в каждом энергетическом уровне совпадает с номером самого энергетического уровня:
| Энергетический уровень | Число подуровней | Орбитали | Максимальное число электронов |
|---|---|---|---|
| n = 1 | 1 | s  |
2 |
| n = 2 | 2 |
s |
8 |
| n = 3 | 3 | s  p  d  |
18 |
| и т.д. |
Электронная конфигурация показывает распределение электронов в атоме по энергетическим уровням, подуровням и орбиталям. Сначала заполняются орбитали с меньшей энергией и далее по возрастанию:
1s → 2s → 2p → 3s → 3p → 4s → ...
Рассмотрим заполнение орбиталей первых 20 элементов периодической таблицы. Верхний индекс показывает количество электронов на соответствующем подуровне. Порядковый номер элемента в периодической таблице показывает количество электронов, которое необходимо распределить по орбиталям.
| Элемент 4-го периода | Электронная конфигурация |
|---|---|
| 1H | 1s1 |
| 2He | 1s2 |
| 3Li | 1s22s1 |
| 4Be | 1s22s2 |
| 5B | 1s22s22p1 |
| 6C | 1s22s22p2 |
| 7N | 1s22s22p3 |
| 8O | 1s22s22p4 |
| 9F | 1s22s22p5 |
| 10Ne | 1s22s22p6 |
| 11Na | 1s22s22p63s1 |
| 12Mg | 1s22s22p63s2 |
| 13Al | 1s22s22p63s23p1 |
| 14Si | 1s22s22p63s23p2 |
| 15P | 1s22s22p63s23p3 |
| 16S | 1s22s22p63s23p4 |
| 17Cl | 1s22s22p63s23p5 |
| 18Ar | 1s22s22p63s23p6 |
| 19K | 1s22s22p63s23p64s1 |
| 20Ca | 1s22s22p63s23p64s2 |
