Химические свойства солей карбоновых кислот
Ниже приведены реакции, которые встречаются в официальных пособиях по подготовке к ЕГЭ, а также на сайте ФИПИ.
1) Взаимодействие с сильными кислотами:
CH3−CH2−COONa + HCl  CH3−CH2−COOH + NaCl ([21], стр. 324)
CH3−CH2−COOH + NaCl ([21], стр. 324)
CH3−COOK + H2SO4  CH3−COOH + KHSO4 ([21], стр. 121)
CH3−COOH + KHSO4 ([21], стр. 121)
+ 2H2SO4  HSO4− + NaHSO4 ([21], стр. 344)
HSO4− + NaHSO4 ([21], стр. 344)
+ HBr  + NaBr ([21], стр. 33)
+ NaBr ([21], стр. 33)
(CH3−COO)2Ca t° + CaCO3 ([1], №4B8E47)
(CH3−COO)2Ba t° + BaCO3 ([1], №D6E6E2)
(CH3−CH2−COO)2Ca t° + CaCO3 ([21], стр. 316)
t° + BaCO3 ([21], стр. 337)
+ NaOH t° CH4 + Na2CO3 ([21], стр. 43)
+ KOH t° CH3−CH3 + K2CO3 ([21], стр. 62)
+ KOH t° CH3−CH2−CH3 + K2CO3 ([21], стр. 71)
+ 2NaOH t° CH3−CH2−CH3 + 2Na2CO3 ([21], стр. 354)
+ 2KOH t° CH3−CH2−CH2−CH3 + 2K2CO3 ([21], стр. 345)
+ NaOH t° + Na2CO3 ([21], стр. 323)
+ NaOH t° + Na2CO3 ([21], стр. 362)
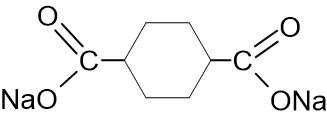 + 2NaOH t° + 2Na2CO3 ([21], стр. 346)
+ 2NaOH t° + 2Na2CO3 ([21], стр. 346)
2CH3−COONa + 2H2O электролиз CH3−CH3 + 2NaOH + H2 + 2CO2 ([1], №BD4E0A)
2CH3−CH2−COOK + 2H2O электролиз CH3−CH2−CH2−CH3 + 2KOH + H2 + 2CO2 ([21], стр. 337)
2 + 2H2O электролиз + 2NaOH + H2 + 2CO2 ([21], стр. 333)
5) Взаимодействие солей аммония с щелочами:
2 + Ca(OH)2  (CH3−COO)2Ca +2NH3↑ + 2H2O ([1], №E2D644)
(CH3−COO)2Ca +2NH3↑ + 2H2O ([1], №E2D644)
6) Взаимодействие с галогеналканами:
+ Cl−CH2−CH3  + NaCl ([1], №3AC5AE)
+ NaCl ([1], №3AC5AE)
+ I−CH2−CH3  + NaI ([1], №BCC43C)
+ NaI ([1], №BCC43C)
+ 2CH3I  + 2NaI ([1], №0B97E8)
+ 2NaI ([1], №0B97E8)
Страница создана в химическом редакторе.
