Модель строения атома
Задания сайта ФИПИ на эту тему можно прорешать в курсе самоподготовки к ОГЭ.
Атом - электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженной электронной оболочки (видео).
Ядро атома состоит из положительно заряженных протонов и нейтральных нейтронов.
Положительный заряд ядра атома равен порядковому номеру элемента в периодической системе.
| Порядковый номер элемента (Z) | = | Заряд ядра атома (Z) | = | Число протонов в ядре (Z) | = | Число электронов в атоме (Z) |
Элемент - это вид атомов с одинаковым зарядом ядра.
Порядковый номер элемента показан в периодической таблице над каждым из элементов. Рассмотрим одну клетку периодической таблицы с хлором:
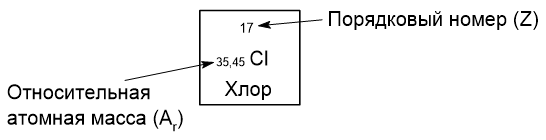
Относительная атомная масса (Ar, безразмерная величина) - это число, которое показывает, во сколько раз масса данного атома больше атомной единицы массы (а.е.м).
Массовое число атома (А) равно сумме протонов (+) и нейтронов в ядре атома и также приблизительно равно относительной атомной массе, так как масса электронов - очень малая величина.
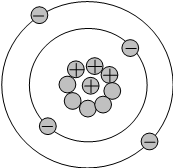
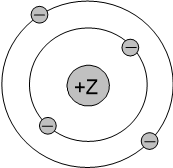
В учебниках модели строения атомов химических элементов могут быть изображены несколькими способами, рассмотрим их на примере атома бериллия:
 |
 |
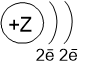 |
Порядковый номер равен 4, следовательно, в ядре находится 4 протона (+) и электронная оболочка состоит из 4 электронов (−). Окружности схематично показывают энергетические уровни, общее число которых соответствует периоду, в котором находится элемент. В данном случае Be находится во втором периоде, поэтому изображены два энергетических уровня.
На каждом энергетическом уровне может находится определённое количество электронов, заполнение уровней происходит от внутренних уровней к внешним.
На первом уровне могут находится только 2 электрона, на втором - 8 электронов, на третьем - 18 и т.д. Подробно строение энергетических уровней обсуждается на другой странице (но на ОГЭ эти знания не проверяются).
Валентные электроны находятся на последнем (внешнем) энергетическом уровне. В атоме бериллия есть 2 валентных электрона.
Номер группы, в которой находится элемент, равен числу электронов на внешнем энергетическом уровне.
Номер периода равен общему числу электронных слоёв в атоме.
Изотопы
Изотопы - атомы одного элемента, которые имеют разные массовые числа. Число протонов в изотопах одинаковое, так как это атомы одного элемента, но число нейтронов разное.
Относительные атомные массы, приведённые в периодической таблице, не являются целыми числами, почему?
Потому что в природе разные элементы имеют разное число изотопов, и процентное содержание каждого изотопа различно.
Например, природный хлор состоит из двух изотопов: Ar = 35 (75,5%) и Ar = 37 (24,5%). В первом случае в ядре находятся 17 протонов и 18 нейтронов, во втором - 17 протонов и 20 нейтронов.
Рассчитаем среднее значение относительной атомной массы с учетом процентного содержания изотопов:
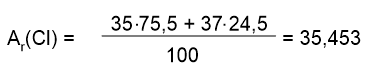
Именно это среднее значение относительной атомной массы показано в периодической таблице.
