Валентность
Задания сайта ФИПИ на эту тему можно прорешать в курсе самостоятельной подготовки к ОГЭ.
Валентность элемента - это число химических связей, которые атом данного элемента образует с другими атомами в данной молекуле. Для образования одной химической связи атом предоставляет один неспаренный электрон. Поэтому валентность элемента определяется числом неспаренных электронов в его атоме, или (более точно) числом ковалентных связей, образуемых данным атомом в соединении. Различные типы связей будут рассмотрены на других страницах данного раздела, пока подробно рассмотрим валентность.
Валентность некоторых элементов в разных соединениях разная. Это возможно тогда, когда атом переходит в возбуждённое состояние.
Возбуждённое состояние атома - это состояние с более высокой энергией, чем основное. В процессе возбуждения атома происходит разъединение спаренных электронов и переход одного из них с данного подуровня на свободную орбиталь другого подуровня в пределах одного энергетического уровня.
В атоме кислорода, например, на втором уровне больше нет свободных орбиталей, поэтому переход в возбуждённое состояние невозможен.
Рассмотрим атом углерода. В периодической системе он шестой, поэтому по орбиталям нужно расположить шесть электронов:
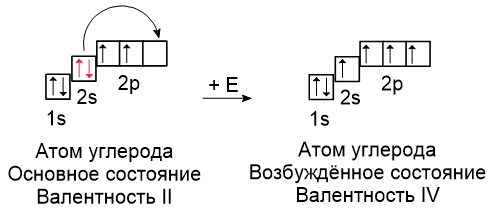
В основном состоянии в атоме углерода на 2p-подуровне есть два неспаренных электрона и одна свободная орбиталь. На этом же энергетическом уровне на 2s-подуровне есть два спаренных электрона (выделены красным), которые могут распариваться, в этом случае один из них переходит на свободную орбиталь. Число неспаренных электронов при этом увеличивается до четырёх.
Согласно определению валентности элемента, атом углерода в основном состоянии является двухвалентным, так как только два электрона являются неспаренными. При поглощении энергии один из электронов 2s-подуровня переходит на свободную орбиталь 2p-подуровня, в результате чего образуется 4 неспаренных электрона, т.е. в возбужденном состоянии углерод является четырёхвалентным. Такую валентность углерод проявляет в большинстве соединений.
Рассмотрим атомы кислорода и серы:
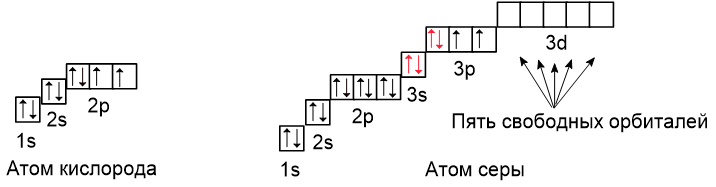
Кислород и сера находятся в разных периодах, поэтому у кислорода внешним является второй энергетический уровень, а у серы третий. В атоме кислорода свободных орбиталей нет, поэтому распаривание электронов невозможно. Валентность кислорода в большинстве соединений равна двум.
Тот факт, что у углерода и кислорода все же может быть валентность равная трём, изучается в одиннадцатом классе и на ОГЭ не встречается.
В атоме серы есть пять свободных орбиталей, на которые могут переходить электроны при распаривании с 3s- и 3p-подуровней. Благодаря наличию этих свободных орбиталей сера имеет разное количество неспаренных электронов и, следовательно, переменную валентность: в разных соединениях она может иметь валентность II (например, в H2S), IV (например, в SO2) или VI (например, в H2SO4).
Высшая валентность - максимальное число ковалентных связей, которое атом данного элемента может образовывать с другими атомами. Значение высшей валентности численно совпадает с номером группы, в которой находится элемент. Но в этом правиле есть исключения: O, N и F (см. таблицу ниже). Постоянная валентность в соединениях в случае неметаллов характерна только для фтора. Все другие неметаллы имеют переменную валентность.
Понятие "валентность" применимо только к элементам в соединениях с ковалентными связями (т.е. связями между двумя неметаллами), поэтому рассмотрим основные неметаллы первых двух периодов и их валентные возможности:
| Элемент | Высшая валентность | Примеры соединений | Высшая валентность равна номеру группы? |
|---|---|---|---|
| C | IV | CO2 | Да |
| N* | IV | NO2, HNO3 | Нет |
| O* | II | H2O, H2SO4 | Нет |
| F | I | HF | Нет |
| Si | IV | SiO2 | Да |
| P | V | P2O5, H3PO4 | Да |
| S | VI | SO3, H2SO4 | Да |
| Cl | VII | Cl2O7, HClO4 | Да |
| Br | VII | Br2O7, HBrO4 | Да |
| I | VII | I2O7, HIO4 | Да |
*Атомы кислорода и азота на внешнем уровне содержат неподеленные электронные пары (2 пары у кислорода и одна у азота), которые также могут участвовать в образовании ковалентных связей по донорно-акцепторному механизму. Поэтому максимальная валентность этих элементов в соединениях больше, чем количество неспаренных электронов. Подробнее эта тема изучается в одинадцатом классе и на ОГЭ не проверяется.
