Закономерности изменения свойств химических элементов и простых веществ
Задания сайта ФИПИ на эту тему можно прорешать в курсе самоподготовки к ОГЭ.
1. Рассмотрим изменения свойств по группам
Электроотрицательность (ЭО) атома - способность атома притягивать к себе валентные электроны других атомов. Фтор является самым электроотрицательным из всех элементов со значением ЭО равным 4,0. Чтобы понять, как электроотрицательность изменяется в группах сверху вниз, рассмотрим следующую таблицу (значения ЭО показаны под символами элементов).
| VI | VII | Электронные оболочки элементов VII группы |
Изменение |
Изменение ЭО |
|
| 2 | O 3,5 |
F 4,0 |
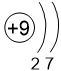 |
 |
 |
| 3 | S 2,5 |
Cl 3,0 |
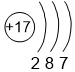 |
 |
|
| 4 | Se 2,4 |
Br 2,8 |
 |
 |
|
| 5 | Te 2,1 |
I 2,5 |
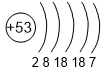 |
 |
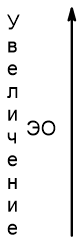
Как видно из таблицы, радиусы атомов сверху вниз увеличиваются, так как увеличивается число заполняемых электронных слоев. Вниз по группе внешние электроны находятся все дальше и дальше от ядра, притяжение к положительно заряженному ядру атома уменьшается, поэтому и уменьшается электроотрицательность, т.е. способность атомов принимать (притягивать) электроны.
Заряд ядра (равный числу протонов в нём) и число электронов на внешнем уровне также возрастают в группах сверху вниз.
Высшая положительная степень окисления равна номеру группы и поэтому не меняется.
Низшая степень окисления (для неметаллов IV-VIIA групп) равна 8 минус номер группы и в группах сверху вниз также не изменяется. Для металлов низшая степень окисления равна нулю и от периода также не зависит.
Окислительные свойства определяются способностью атомов притягивать (принимать) электроны. Радиусы атомов сверху вниз увеличиваются (так как увеличивается число заполненных электронных слоев), внешние электроны находятся все дальше и дальше от ядра, притяжение к положительно заряженному ядру атома уменьшается. Поэтому и уменьшается способность атомов принимать (притягивать) электроны, т.е. окислительные свойства уменьшаются.
Неметаллические свойства простых веществ также определяются способностью притягивать электроны, поэтому в главных подгруппах сверху вниз эти свойства также уменьшаются.
Восстановительные свойства определяются способностью атомов отдавать электроны. Эти свойства возрастают в группах сверху вниз. Это объясняется тем, что чем больше радиус атома, тем легче атому отдавать электроны.
Металлические свойства простых веществ также определяются способностью отдавать электроны, поэтому в главных подгруппах сверху вниз эти свойства также увеличиваются.
2. Рассмотрим изменения свойств по периодам
Двигаясь вдоль периода слева направо, электроны сильнее притягиваются к ядру, так как количество протонов в ядре также возрастает, радиус атома уменьшается. Благодаря этому возрастает способность атома притягивать к себе валентные электроны других атомов (т.е. ЭО) до получения завершенного энергетического уровня, т.е. возрастают электроотрицательность, окислительные свойства атомов и неметаллические свойства простых веществ.
| I | II | III | IV | V | VI | VII | |
|
Электронные оболочки |
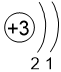 |
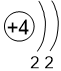 |
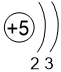 |
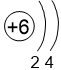 |
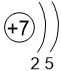 |
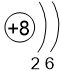 |
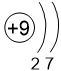 |
| 2 | Li 1,0 |
Be 1,5 |
B 2,0 |
C 2,5 |
N 3,0 |
O 3,5 |
F 4,0 |
| 3 | Na 0,9 |
Mg 1,2 |
Al 1,5 |
Si 1,8 |
P 2,1 |
S 2,5 |
Cl 3,0 |
| Изменение размера атомов |
 |
 |
 |
 |
 |
 |
 |
| Изменение электроотрицательности |  Увеличение электроотрицательности |
||||||
Заряд ядра, число электронных слоёв и число электронов на внешнем слое также увеличиваются.
Высшая положительная степень окисления равна номеру группы и поэтому вдоль периода увеличивается.
Низшая степень окисления (для неметаллов IV-VIIA групп) увеличивается от -4 до -1. Для металлов низшая степень окисления равна нулю и от периода или группы не зависит.
Восстановительные свойства определяются способностью атомов отдавать электроны. Эти свойства уменьшаются вдоль периода слева направо. Это объясняется тем, что электроны находятся все ближе и ближе к ядру (так как число протонов в ядре увеличивается), и сильнее к нему притягиваются. Чем сильнее притяжение к ядру, тем сложнее атому отдать электрон.
Металлические свойства простых веществ также определяются способностью отдавать электроны, поэтому аналогично восстановительным свойствам в периодах они ослабевают.
Вышесказанные рассуждения можно представить в виде таблицы, в которой стрелками показано увеличение соответствующих свойств:
| Свойство | В группах | В периодах |
|---|---|---|
| Окислительные свойства атомов и неметаллические свойства простых веществ | 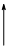 |
 |
| Восстановительные свойства атомов и металлические свойства простых веществ |  |
 |
