Закономерности изменения свойств высших оксидов и гидроксидов
Задания сайта ФИПИ на эту тему можно прорешать в курсе самостоятельной подготовки к ОГЭ.
Высший оксид - оксид, в котором элемент находится в максимальной степени окисления.
Аналогично, высший гидроксид - гидроксид, в котором элемент находится в максимальной степени окисления.
Кислотные свойства высших оксидов и гидроксидов изменяются аналогично окислительным свойствам элемента, который их образует. Например, в ряду высших оксидов B2O3 -> CO2 -> N2O5 нужно рассмотреть ряд элементов B -> C -> N в периодической таблице химических элементов. В этом ряду окислительные свойства увеличиваются, следовательно, и кислотные свойства их высших оксидов также увеличиваются.
Оснóвные свойства высших оксидов и гидроксидов изменяются аналогично восстановительным свойствам соответствующего элемента. В рассматриваемом выше ряду оснóвные свойства ослабевают.
Изменение свойств вдоль периодов
Рассмотрим высшие оксиды и гидроксиды элементов 2-го периода:
| Группа | I | II | III | IV | V | VI | VII |
|---|---|---|---|---|---|---|---|
| Li | Be | B | C | N | O | F | |
| Высшие оксиды | Li2O | BeO | B2O3 | CO2 | N2O5 | - | - |
| Высшие гидроксиды | LiOH | Be(OH)2 | H3BO3 | H2CO3 | HNO3 | - | - |
| Свойства | Основные | Амфотерные | Кислотные | Кислотные | Кислотные | - | - |
| Тип гидроксида | Растворимое основание | Амфотерный гидроксид | Слабая кислота | Слабая кислота | Сильная кислота | - | - |
| Изменение кислотных свойств |  Кислотные свойства усиливаются |
||||||
Оснóвные свойства изменяются в обратном порядке, т.е. ослабевают вдоль периода слева направо.
Рассмотрим высшие оксиды и гидроксиды элементов 3-го периода:
| Группа | I | II | III | IV | V | VI | VII |
|---|---|---|---|---|---|---|---|
| Na | Mg | Al | Si | P | S | Cl | |
| Высшие оксиды | Na2O | MgO | Al2O3 | SiO2 | P2O5 | SO3 | Cl2O7 |
| Высшие гидроксиды | NaOH | Mg(OH)2 | Al(OH)3 | H2SiO3 | H3PO4 | H2SO4 | HClO4 |
| Свойства | Основные | Основные | Амфотерные | Кислотные | Кислотные | Кислотные | Кислотные |
| Тип гидроксида | Растворимое основание | Нерастворимое основание | Амфотерный гидроксид | Слабая кислота | Кислота средней силы | Сильная кислота | Сильная кислота |
| Изменение кислотных свойств |  Кислотные свойства усиливаются |
||||||
Все оксиды металлов первой группы главной подгруппы являются оснóвными, далее, двигаясь вдоль периода, свойства становятся амфотерными (Al2O3, Al(OH)3) и затем кислотными. Таким образом, в периодах слева направо кислотные свойства усиливаются, а основные ослабевают.
Кислотные свойства водородных соединений неметаллов по периоду слева направо также увеличиваются, так как неметаллические свойства их элементов увеличиваются. Например, в ряду NH3, H2O, HF наблюдается усиление кислотных свойств. Раствор аммиака является слабым основанием, тогда как раствор HF - это слабая кислота.
Изменение свойств в группах сверху вниз
Рассмотрим элементы второй группы 2-го, 3-го и 4-го периода. Двигаясь снизу вверх, свойства от основных переходят к амфотерным, т.е. кислотные свойства усиливаются.
| Период | Элемент II гр. |
Высший оксид | Высший гидроксид | Изменение кислотных свойств | |
|---|---|---|---|---|---|
| 2 | Be | BeO амфотерный оксид |
Be(OH)2 амфотерный гидроксид |
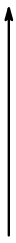 |
Кислотные свойства усиливаются |
| 3 | Mg | MgO оснóвный оксид |
Mg(OH)2 нерастворимое основание |
||
| 4 | Ca | CaO оснóвный оксид |
Ca(OH)2 малорастворимое основание |
||
Рассмотрим элементы третьей группы 2-го и 3-го периода. Двигаясь снизу вверх, свойства от амфотерных переходят к кислотным, т.е. кислотные свойства усиливаются.
| Период | Элемент III гр. |
Высший оксид | Высший гидроксид | Изменение кислотных свойств | |
|---|---|---|---|---|---|
| 2 | B | B2O3 кислотный оксид |
H3BO3 слабая кислота |
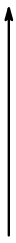 |
Кислотные свойства усиливаются |
| 3 | Al | Al2O3 амфотерный оксид |
Al(OH)3 амфотерный гидроксид |
||
Рассмотрим элементы пятой группы 2-го и 3-го периода. Двигаясь снизу вверх, кислотные свойства усиливаются.
| Период | Элемент V гр. |
Высший оксид | Высший гидроксид | Изменение кислотных свойств | |
|---|---|---|---|---|---|
| 2 | N | N2O5 кислотный оксид |
HNO3 сильная кислота |
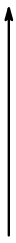 |
Кислотные свойства усиливаются |
| 3 | P | P2O5 кислотный оксид |
H3PO4 кислота средней силы |
||
Оснóвные свойства изменяются в обратном порядке, т.е. ослабевают в группах снизу вверх.
Кислотные свойства водородных соединений (бескислородных кислот)
Рассмотрим ряд соединений (а точнее их водные растворы): HF, HCl, HBr, HI. Двигаясь по группе сверху вниз, размер атомов F, Cl, Br, I увеличивается (так как растет число электронных слоев). В результате чего связь H-Г (Г - галоген) ослабевает и удлиняется. Так как эта связь становится слабее (в группе сверху вниз), кислота становится сильнее (так как становится все проще и проще отщепить протон).
