Соли
Задания сайта ФИПИ на эту тему можно прорешать в курсе самостоятельной подготовки к ОГЭ.
Соли - это сложные вещества, которые являются продуктами замещения атомов водорода в молекулах кислот атомами металла (или катионом аммония) или продуктами замещения гидроксильных групп в молекулах оснований кислотными остатками.
Например, если в кислоте HNO3 атом водорода заменить на металл K, то получим соль KNO3. Если в основании Ca(OH)2 заменить гидроксильные группы на кислотные остатки -NO3, то также получаем соль: Ca(NO3)2.
Если кислота содержит несколько атомов водорода, и все эти атомы замещены атомами металла (или катионами аммония), то такие соли называются средними. Наример: Na2SO4, K2CO3, (NH4)2SO3 и др.
Если на металл (или катион аммония) замещены не все атомы водорода, то такие соли называются кислыми. Например: NaHSO4 (в кислоте H2SO4 только один атом водорода замещён на атом натрия), (NH4)H2PO4 (в кислоте H3PO4 только один атом водорода замещён на катион аммония).
Примеры названий кислых солей приведены в конце данной страницы.
Средние соли
Рассмотрим все кислотные остатки кислородсодержащих кислот и соответствующие им кислоты, которые встречаются в заданиях на классификацию:
| Кислотный остаток | Название кислотного остатка | Кислота | Название кислоты |
|---|---|---|---|
| CO32– | карбонат | H2CO3 | Угольная кислота |
| SiO32– | силикат | H2SiO3 | Кремниевая кислота |
| NO3– | нитрат | HNO3 | Азотная кислота |
| NO2– | нитрит | HNO2 | Азотистая кислота |
| PO43– | фосфат | H3PO4 | Фосфорная кислота |
| SO42– | сульфат | H2SO4 | Серная кислота |
| SO32– | сульфит | H2SO3 | Сернистая кислота |
| CrO42– | хромат | H2CrO4 | Хромовая кислота |
| Cr2O72– | дихромат | H2Cr2O7 | Дихромовая кислота |
| ClO4– | перхлорат* | HClO4 | Хлорная кислота* |
| ClO3– | хлорат* | HClO3 | Хлорноватая* |
| ClO2– | хлорит* | HClO2 | Хлористая* |
| ClO– | гипохлорит* | HClO | Хлорноватистая* |
| MnO42– | манганат | H2MnO4 | Марганцóвистая кислота |
| MnO4– | перманганат | HMnO4 | Марганцóвая кислота |
* Названия кислот хлора и их солей для ОГЭ знать не нужно (они нужны только для ЕГЭ), но необходимо знать, что такие кислоты и кислотные остатки существуют, так как они встречаются в заданиях на классификацию. Т.е. нужно уметь определять, что NaClO4, например, это соль.
Рассмотрим все кислотные остатки бескислородных кислот и соответствующие им кислоты, которые встречаются в заданиях на классификацию:
| Кислотный остаток | Название кислотного остатка | Кислота | Название кислоты |
|---|---|---|---|
| F– | фторид | HF | Фтороводородная кислота (плавиковая к-та) |
| Cl– | хлорид | HCl | Хлороводородная кислота (соляная к-та) |
| Br– | бромид | HBr | Бромоводородная кислота |
| I– | йодид | HI | Йодоводородная кислота |
| S2– | сульфид | H2S | Сероводородная кислота |
Суммарный заряд в формульной единице соли должен быть равен нулю. Заряды металлов (и катиона аммония), а также кислотных остатков показаны в таблице растворимости.
1. Составим формулу нитрата натрия. Смотрим заряды в таблице растворимости: Na+ и NO3–. Так как численно заряды одинаковые, никаких индексов в формуле соли ставить не нужно, получаем формулу соли: NaNO3.
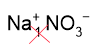
2. Составим формулу сульфата железа (II), замечая, что заряд железа равен 2+ (в скобках указана степень окисления римскими цифрами). Смотрим заряд сульфат-ионов в таблице растворимости: SO42–. Численно заряды совпадают, поэтому индексы снова не пишем: FeSO4.
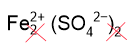
3. Составим формулу нитрата железа (III), замечая, что заряд железа равен 3+ (в скобках указана степень окисления римскими цифрами). Смотрим заряд нитрат-ионов в таблице растворимости: NO3–. Получаем Fe3+ и NO3–. Составляем формулу соли, т.е. переносим заряды на место индексов крест-накрест без знака, но индекс "1" не пишем. Получаем формулу Fe(NO3)3.
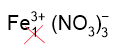
4. Составим формулу сульфата железа (III), замечая, что заряд железа также равен 3+. Смотрим заряд сульфат-ионов в таблице растворимости: SO42–. Получаем Fe3+ и SO42–. Составляем формулу соли, т.е. переносим заряды на место индексов крест-накрест без знака. Получаем формулу Fe2(SO4)3.

Кислые соли
Если соль содержит один атом водорода, то к названию добавляется "гидро". Например:
NaHSO3 - гидросульфит натрия
(NH4)HSO4 - гидросульфат аммония
(NH4)2HPO4 - гидрофосфат аммония
Если соль содержит два атома водорода, то к названию добавляется "дигидро". Например:
NaH2PO4 - дигидрофосфат натрия
Ca(H2PO4) - дигидрофосфат кальция
(NH4)H2PO4 - дигидрофосфат аммония.
