Расстановка коэффициентов методом электронного баланса. Базовые знания
Рассмотрим разные типы реакций, в которых определение коэффициентов методом электронного баланса немного отличается. Типы реакций даны от простых к сложным.
1. Все атомы одного элемента полностью переходят из одной степени окисления в другую.
Это самый простой случай расставления коэффициентов.
Рассмотрим реакцию окисления фосфина. В этой реакции все атомы фосфора из фосфина окисляются до степени окисления +5, и все атомы азота в азотной кислоте восстанавливаются с образованием NO2:
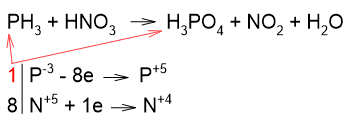
Коэффициенты из электронного баланса переносим в уравнение реакции: коэффициент 1 ставим и перед фосфином, и перед фосфорной кислотой (в уравнении не пишем). Аналогично, коэффициент 8 ставим и перед азотной кислотой, и перед оксидом азота (IV):
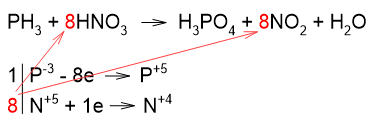
Считаем количество атомов кислорода в реагентах (24 атома), следовательно, перед водой ставим коэффициент 4. Убеждаемся, что число атомов водорода уравнялось:
PH3 + 8HNO3 -> H3PO4 + 8NO2↑ + 4H2O
Рассмотрим реакцию йода с концентрированной азотной кислотой.
Аналогично предыдущему примеру, в данной реакции все атомы азота азотной кислоты восстанавливаются до степени окисления +4. Поэтому коэффициенты перед HNO3 и перед NO2 берём из электронного баланса:
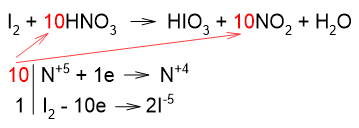
Все атомы йода окисляются с образованием HIO3, поэтому коэффициенты также берём из электронного баланса, но с учетом того, что молекулярный йод состоит из двух атомов, а в йодноватой кислоте атом иода один:
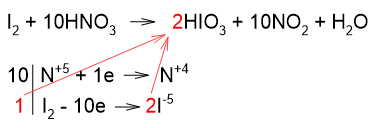
Считаем количество атомов кислорода в реагентах (30) и вычисляем коэффициент перед водой:
I2 + 10HNO3(конц.) -> 2HIO3 + 10NO2↑ + 4H2O.
Другие примеры
В следующих реакциях коэффициенты расставляются по аналогичной схеме (предлагаем найти их самостоятельно):
Na3P + Cl2 + NaOH -> Na3PO4 + NaCl + H2O (ответ)
PH3 + H2SO4(конц.) -> H3PO4 + SO2↑ + H2O (ответ)
H2S + HNO3(конц.) -> H2SO4 + NO2↑ + H2O (ответ)
CuS + HNO3 -> CuSO4 + NO2↑ + H2O (ответ)
Ответы также можно проверить в тренажёре реакций.
2. Часть атомов одного элемента изменяет степень окисления, а у другой части атомов степень окисления остаётся прежней.
Рассмотрим взаимодействие меди с концентрированной азотной кислотой.
Из уравнения реакции видим, что все атомы меди переходят в нитрат меди (II), следовательно, коэффициенты перед Cu и Cu(NO3)2 берём из электронного баланса (коэффициент 1 в уравнении не пишем).
Далее замечаем, что не все атомы азота из азотной кислоты перешли в NO2, часть нитрат-ионов осталась для образования соли Cu(NO3)2. Поэтому коэффициент 2 из электронного баланса мы не можем поставить перед всеми соединениями, содержащими азот (HNO3, Cu(NO3)2, NO2). Коэффициент из электронного баланса ставим только перед тем соединением, в котором атомы азота изменили степень окисления, т.е. только перед NO2:
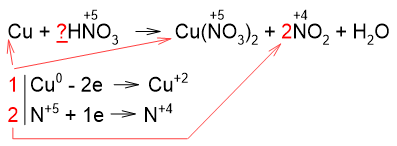
На следующем шаге видим, что в продуктах имеются 4 атома азота (2 в нитрат-ионах и 2 в NO2), поэтому перед азотной кислотой ставим коэффициент 4:
Cu + 4HNO3(конц.) -> Cu(NO3)2 + 2NO2↑ + H2O.
И на последнем шаге вычисляем коэффициент перед водой:
Cu + 4HNO3(конц.) -> Cu(NO3)2 + 2NO2↑ + 2H2O.
Другие примеры
В следующих реакциях коэффициенты расставляются по аналогичной схеме (предлагаем найти их самостоятельно):
2Cu(NO3)2 + 4KI -> 2CuI + I2 + 4KNO3 (ответ)
HCl + KMnO4 -> Cl2 + KCl + MnCl2 + H2O (ответ)
HBr + K2Cr2O7 -> Br2 + CrBr3 + KBr + H2O (ответ)
HBr + MnO2 -> Br2 + MnBr2 + H2O (ответ).
Ответы также можно проверить в тренажёре реакций.
3. Реакции сопропорционирования
Реакции сопропорционирования - это окислительно-восстановительные реакции, в которых атомы одного и того же элемента, находящиеся в разных степенях окисления, приобретают одну промежуточную степень окисления, например:
2NaNO3 + (NH4)2SO4 → 2N2O + Na2SO4 + 4H2O
В этой реакции атомы азота N+5 и N−3 переходят в одну степень окисления: +1.
Составим электронный баланс:
1| 2N+5 + 8e → 2N+1
1| 2N−3 − 8e → 2N+1
В таких реакциях нужно взять коэффициенты из электронного баланса и поставить только в левую часть уравнения, т.е. перед соединениями NaNO3 и (NH4)2SO4. Перед NaNO3 ставим коэффициент 2, так как в электронном балансе стоит дополнительный коэффициент 2 (выделен красным). Перед (NH4)2SO4 нужно поставить коэффициент 1, но его не пишем.
В сумме в левой части уравнения имеем 4 атома азота, поэтому в правой части уравнения перед N2O ставим коэффициент 2. Атомы натрия и серы уже уравнены. На последнем шаге вычисляем коэффициент перед молекулой воды: в левой части уравнения есть 8 атомов водорода, поэтому перед водой ставим коэффициент 4. По кислороду проверяем, что коэффициенты найдены верно.
4. Реакции, в которых образется несколько соединений с одинаковой степенью окисления
Часто встречаются реакции, в которых степень окисления меняется, но образуется не одно, а несколько новых соединений с новой степенью окисления. Например:
HMnO4 + HNO2 → Mn(NO3)2 + HNO3 + H2O
В этой реакции азот окисляется до ст. ок. +5 и в продуктах присутствует в двух соедиениях: Mn(NO3)2 и HNO3. В таком случае коэффициент из баланса мы должны поставить только перед соединением азота в реагентах (т.е. толко перед HNO2 ставим коэффициент 5), так как соотношение соединений в продуктах нам пока неизвестно.
Mn+7 весь восстанавливается и переходит в Mn+2, поэтому перед соединениями HMnO4 и Mn(NO3)2 ставим коэффициент 2 из электронного баланса.
Электронный баланс:
2| Mn+7 +5e → Mn+2
5| N+3 –2e → N+5
2HMnO4 + 5HNO2 → 2Mn(NO3)2 + HNO3 + H2O
Видим, что слева имеем 5 атомов азота (5HNO2), а в продуктах 4 атома азота в 2Mn(NO3)2. Следовательно перед HNO3 ставим коэффициент 1 (не пишем), чтобы в сумме было 5 атомов как и в реагентах.
На последнем шаге вычисляем коэффициент перед молекулой воды. В левой части уравнения имеем 7 атомов водорода, поэтому перед водой ставим коэффициент 3. По кислороду можно убедиться в том, что коэффициенты расставлены верно:
2HMnO4 + 5HNO2 → 2Mn(NO3)2 + HNO3 + 3H2O.
Другие примеры
В следующей реакции коэффициенты расставляются по аналогичной схеме (предлагаем найти их самостоятельно):
C + KNO3 → K2CO3 + CO2 + N2.
