Ковалентный тип связи. Электроотрицательность
Задания открытого банка ФИПИ на эту тему можно прорешать в данном уроке.
Электроотрицательность (ЭО) атома - способность атома притягивать к себе валентные электроны других атомов.
Фтор является самым электроотрицательным из всех элементов, за ним следует кислород, хлор, азот и другие элементы:
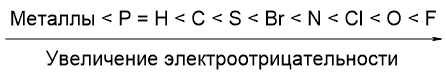
Ковалентная связь - это связь атомов в молекулах с помощью общих электронных пар.
Существует два механизма образования ковалентной связи.
1) Обменный механизм. Каждый атом отдаёт в общее пользование по одному электрону.
Образование ковалентной связи в молекуле H2:
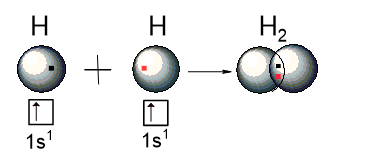
В этом случае происходит образование ковалентной связи между атомами с одинаковой электроотрицательностью. Такая связь называется ковалентная неполярная.
Рассмотрим образование ковалентной связи в молекуле HF. Красными точками показаны 7 валентных электронов в атоме фтора:
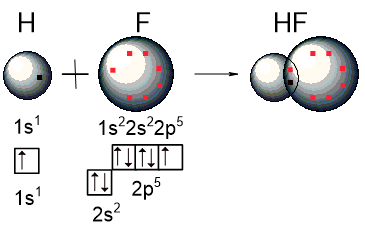
Если связь образуется между атомами с разной электроотрицательностью, как в случае HF, она называется ковалентная полярная. Общая электронная пара смещается к более электроотрицательному элементу, но не полностью, как в случае ионной связи.
2) Донорно-акцепторный механизм. Один атом является донором электронной пары и предоставляет её в общее пользование другому атому, который является акцептором. Акцептор в свою очередь предоставляет свободную орбиталь. Рассмотрим этот механизм на примере образования катиона аммония NH4+:
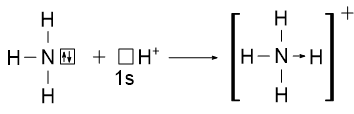
В данном катионе три ковалентные связи образованы по обменному механизму и одна - по донорно-акцепторному механизму. Все четыре ковалентные связи являются равноценными. Графически связь, образованную по донорно-акцепторному механизму, изображают стрелкой от донора электронной пары к акцептору.
Рассмотрим электронную конфигурацию атома азота, на внешнем уровне находятся 5 электронов (выделены красным): три неспаренных электрона и одна неподелённая электронная пара.
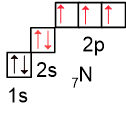
На втором уровне нет d-подуровня, следовательно, распаривание 2s-электронов невозможно. Как результат, атом азота может иметь валентность III (например, в молекуле NH3) или IV, если дополнительная ковалентная связь образуется по донорно-акцепторному механизму, как, например, в катионе аммония NH4+ или азотной кислоте.
Другие соединения, в которых одна из ковалентных связей образуется по донорно-акцепторному механизму:
1) Катион гидроксония H3O+
У атома кислорода на внешнем энергетическом уровне есть две неподелённые электронные пары (электрона конфигурация 1s22s22p4):
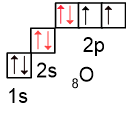
Одна из этих пар участвует в образовании третьей ковалентной связи по донорно-акцепторному механизму:
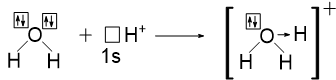
Валентность атома кислорода в данном случае равна III, так как он образует три связи: две связси по обменному механизму и одну связь по донорно-акцепторному механизму.
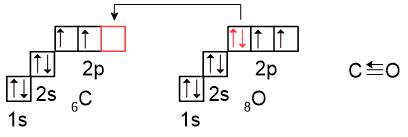
2) Оксид углерода (III) CO
В оксиде CO атомы углерода и кислорода имеют валентность III. Две ковалентные связи образованы по обменному механизму, и еще одна ковалентная связь образована по донорно-акцепторному механизму (орбиталь и неподелённая электронная пара выделены красным).
3) Озон O3 и азотная кислота HNO3
В рамках ЕГЭ достаточно знать то, что в этих соединениях одна из связей образована по донорно-акцепторному механизму, покажем это графически (стрелкой):
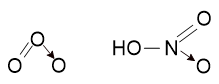
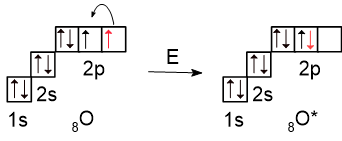
Но для самых любознательных рассмотрим электронные конфигурации атомов, чтобы понять, где именно происходит образование связи по донорно-акцепторному механизму. В этих соединениях один из атомов кислорода находится в возбуждённом состоянии - два валентных неспаренных электрона соединяются, образуя неподелённую пару. Так как на втором уровне отсутствует d-подуровень, распаривание электронов невозможно.
Схематически образование связей в молекуле озона можно показать следующим образом:
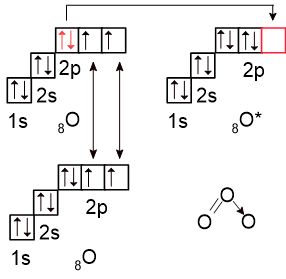
Один из атомов кислорода предоставляет одну свою неподелённую электронную пару, а другой - свободную орбиталь, полученную в результате возбуждения атома (выделены красным).
В молекуле азотной кислоты ситуация очень похожа: для образования связи по донорно-акцепторному механизму неподелённая электронная пара азота смещается к свободной орбитали атома кислорода в возбуждённом состоянии (выделены красным):
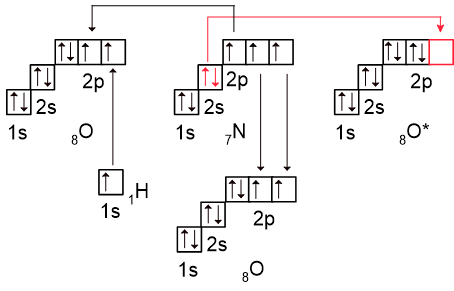
Так как кислород является более электроотрицательным элементом, чем азот, он смещает к себе один или два электрона атома азота, но не полностью. Образуется полярная ковалентная связь.
Валентность азота в азотной кислоте равна IV, а степень окисления равна +5, но об этом речь пойдёт в следующем уроке.
В рамках ЕГЭ можно считать, что ковалентная неполярная связь образуется между дувмя атомами одного неметалла (Cl2, Br2, O2 и др.). А также в таких молекулах, как CH3-CH3 или H2O2 (HO-OH), между двумя атомами углерода и между двумя атомами кислорода, т.е. с симметричным распределением электронной плотности. Связь С-Н и О-Н в этих соединениях является ковалентной полярной. Другие сложные соединения, в которых присутствует неполярная ковалентная связь: этиленгликоль, бутадиен-1,3, ацетиленид натрия, бензоат калия.
Ковалентная полярная связь образуется между атомами разных неметаллов в сложных соединениях: кислотных оксидах неметаллов (NO2, SO2 и др.), кислотах (H2SO3, H2SO4 и др.), кислотных остатках солей (SO42–, NO3– и др.), водородных соединениях (NH3, H2S и др.), а также в гидроксильной группе OH–, катионе аммония NH4+ и др.
