Основное и возбуждённое состояния атома. Валентность
Основное (устойчивое) состояние атома - это такое состояние, которое характеризуется минимальной энергией. Поэтому электроны заполняют орбитали в порядке увеличения их энергии.
Вспомним порядок заполнения подуровней электронами:
1s -> 2s -> 2p -> 3s -> 3p -> 4s -> 3d -> 4p -> 5s -> ...
На каждом из подуровней может находиться определенное количество электронов (обсуждалось ранее): s-подуровень представляет собой одну орбиталь, на которой могут находиться максимум два электрона; p-подуровень состоит из трёх орбиталей, а максимальное число электронов - 6:
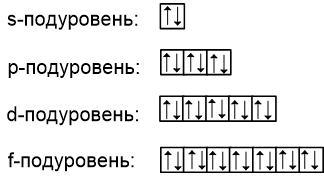
Но как правильно распределить электроны по орбиталям в пределах одного подуровня?
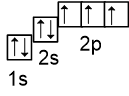
Согласно правилу Гунда сначала на каждой орбитали одного подуровня размещается по одному электрону (стрелкой вверх), затем в каждую из орбиталей помещают по второму электрону (стрелка вниз). Рассмотрим пример заполнения орбиталей в атоме кислорода. Порядковый номер в периодической таблице равен 8, следовательно по орбиталям нужно разместить 8 электронов. Орбитали (клеточки) рисуем снизу вверх, т.е. внизу всегда находится 1s-подуровень, имеющий наименьшую энергию. Выше этого подуровня рисуем следующий 2s-подуровень и далее 2p-подуровень.
Сначала поместим 2 электрона на первую s-орбиталь, затем 2 электрона на 2s-орбиталь, затем 3 электрона на каждую из трёх орбиталей 2p-подуровня (разместили 7 электронов из 8):
На последнем шаге поместим 8-ой электрон на первую орбиталь 2p-подуровня стрелкой вниз:
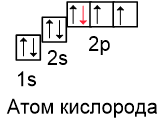
Вспомним, что два электрона, находящиеся на одной орбитали, называются спаренными (или неподелённой электронной парой). Если электрон на орбитали один, его называют неспаренным.
Расставляя электроны таким образом, получаем основное состояние атома. Следовательно, в основном состоянии в атоме кислорда есть 2 неспаренных электрона.
Возбуждённое состояние атома - это состояние с более высокой энергией, чем основное. В процессе возбуждения атома происходит разъединение спаренных электронов и переход одного из них с данного подуровня на свободную орбиталь другого подуровня в пределах одного энергетического уровня.
В атоме кислорода на втором уровне больше нет свободных орбиталей, поэтому переход в возбуждённое состояние невозможен.
Рассмотрим атом углерода. В периодической системе он шестой, поэтому по орбиталям нужно расположить шесть электронов:
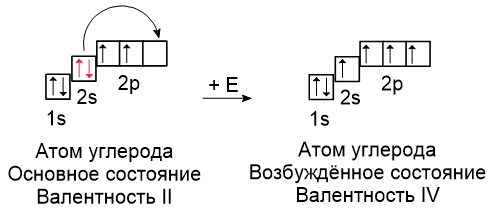
В основном состоянии в атоме углерода на 2p-подуровне есть два неспаренных электрона и одна свободная орбиталь. На этом же энергетическом уровне на 2s-подуровне есть два спаренных электрона (выделены красным), которые могут распариваться, в этом случае один из них переходит на свободную орбиталь. Число неспаренных электронов при этом увеличивается до четырёх.
Валентность элемента - это число химических связей, которые атом данного элемента образует с другими атомами в данной молекуле. Для образования одной химической связи атом предоставляет один неспаренный электрон. Поэтому валентность элемента определяется числом неспаренных электронов в его атоме, или (более точно) числом ковалентных связей, образуемых данным атомом в соединении. Различные типы связей будут рассмотрены в следующем уроке, пока подробно рассмотрим понятие валентность.
Согласно определению валентности элемента, атом углерода в основном состоянии является двухвалентным, так как только два электрона являются неспаренными. При поглощении энергии один из электронов 2s-подуровня переходит на свободную орбиталь 2p-подуровня, в результате чего образуется 4 неспаренных электрона, т.е. в возбужденном состоянии углерод является четырёхвалентным. Такую валентность углерод проявляет в большинстве соединений.
Рассмотрим атомы кислорода и серы:
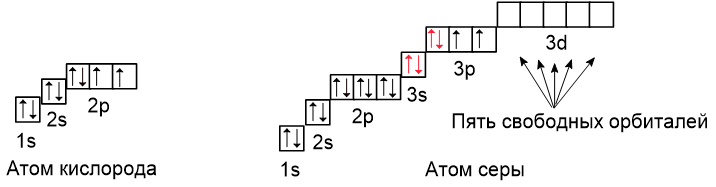
Кислород и сера находятся в разных периодах, поэтому у кислорода внешним является второй энергетический уровень, а у серы третий. В атоме кислорода свободных орбиталей нет, поэтому распаривание электронов невозможно. Несмотря на это, кислород может иметь валентность III, это происходит благодаря тому, что орбиталь с неподелённой электронной парой также может принимать участие в образовании ковалентной связи, но по донорно-акцепторному механизму. О нём речь пойдёт в следующем уроке.
В атоме серы есть пять свободных орбиталей, на которые могут переходить электроны при распаривании с 3s- и 3p-подуровней:
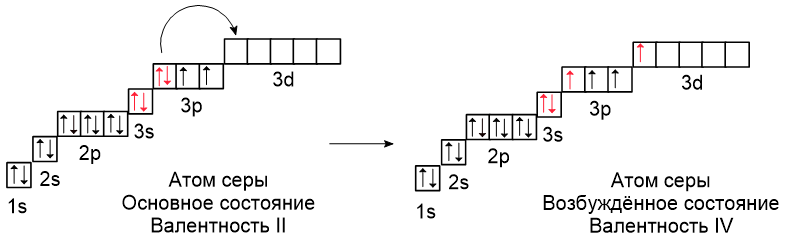
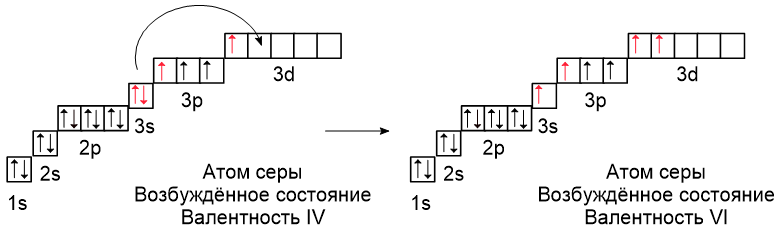
Благодаря наличию свободных орбиталей сера имеет разное количество неспаренных электронов и, следовательно, переменную валентность: в разных соединениях она может иметь валентность II (например, в H2S), IV (например, в SO2) или VI (например, в H2SO4).
Валентные возможности атома азота (III и IV) подробно рассматриваются на другой странице этого раздела, так как образование дополнительной ковалентной связи возможно не за счёт распаривания электронных пар (как, например у серы или фосфора), а за счет наличия у азота одной неподеленной электронной пары на внешнем энергетическом уровне.
