Ионный тип связи. Ионы
Задания открытого банка ФИПИ на эту тему можно прорешать в данном уроке.
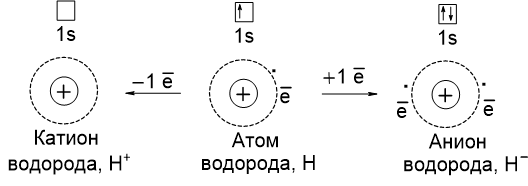
Ионы - атомы или группы атомов, которые имеют положительный или отрицательный заряд, и могут существовать в виде самостоятельных частиц.
Рассмотрим атом водорода с электронной конфигурацией 1s1. В результате отдачи электрона он превращается в положительно заряженный ион - катион. Если к атому водорода присоединяется один электрон, то он преврвщается в отрицательно заряженный ион - анион:
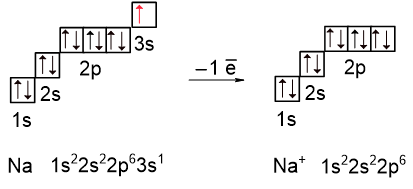
Валентные электроны щелочных и щелочно-земельных металлов связаны с ядром слабее, чем в случае других металлов, поэтому из них катионы образуются легче всего. Рассмотрим натрий, в атоме которого находится 11 электронов. Как видно из электронной конфигурации (см. следующий рисунок), последний электрон находится на 3s-орбитали. Атом натрия его легко отдаёт и приобретает электронную конфигурацию с полностью завершенными энергетическими уровнями (или электронную конфигурацию благородного газа).
Во время образования химической связи все атомы стремятся к электронной конфигурации благородных газов, так как это энергетически более выгодно.
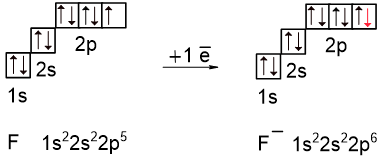
Рассмотрим другой случай, когда до завершения энергетического уровня не хватает всего одного или двух электронов - в случае элементов VIA (O, S, Se, Te) и VIIA подгрупп (F, Cl, Br, I, At). Во время образования химической связи эти атомы стремятся приобрести недостающие электроны, становясь анионами, чтобы получить электронную конфигурацию благородного газа. На следующем рисунке показано образование аниона F–:
В рамках ЕГЭ рассматриваются 4 типа химической связи:
1. Ионная
2. Ковалентная
4. Водородная
В этом уроке рассмотрим только ионный тип связи.
Ионная связь образуется, если один или несколько электронов полностью переходят от одного из взаимодействующих атомов к другому. Например, в результате взаимодействия атомов натрия и фтора, валентный электрон натрия полностью переходит к фтору, в результате чего образуются два иона: Na+ и F–:
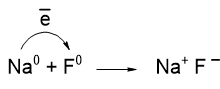
Более детальная схема образования фторида натрия показана на следующем рисунке:
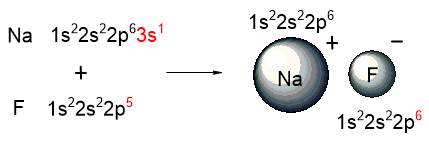
В атоме натрия красным выделен один валентный электрон, который переходит к фтору, делая его внешний энергетический уровень завершенным.
Соединения, в которых присутствует ионный тип связи:
1. Оксиды щелочных и щелочно-земельных металлов: Li2O, Na2O, K2O, Rb2O, Cs2O, CaO, SrO, BaO, RaO (между атомами металла и кислорода).
2. Гидроксиды щелочных и щелочно-земельных металлов: LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2, Ra(OH)2 (между атомами металла и всей гидроксильной группой).
3. Соли. Атомы металла и кислотного остатка соединяются посредством ионной связи, например: NaCl (ионы Na+ и Cl–), Ca(NO3)2 (ионы Ca2+ и NO3–). В солях аммония катион NH4+ соединяется с кислотным остатком также посредством электростатического притяжения, т.е. посредством ионной связи: например, в соединениях NH4NO3 (ионы NH4+ и NO3–), (NH4)2SO4 (ионы NH4+ и SO42–) и др.
4. Органические соли, алкоголяты, феноляты, соли аминов, например, [CH3NH3]Cl и др.
Атомы кислородсодержащих кислотных остатков соединяются между собой посредством ковалентной полярной связи, о которой речь пойдёт в следующем уроке.
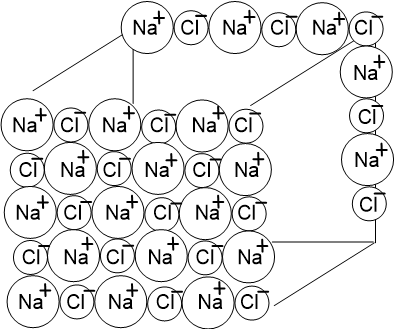
Кристалл ионного соединения состоит из большого числа ионов и представляет собой одну огромную молекулу, поэтому выражение "молекула NaCl" теряет смысл. В этом случае NaCl (или формулу другого ионного соединения) называют формульной единицей вещества.
Схематическое и реальное изображение кристалла NaCl:
 |
 |
Так как электростатическое притяжение является основой ионной связи, то к одному положительно заряженному иону может притягиваться большое количество отрицательно заряженных ионов и наоборот. Отсюда следуют основные свойства ионной связи: ненаправленность и ненасыщаемость. Так как число связей в случае ионной связи неограниченно, понятие валентность применять мы не можем.
