Оксиды. Базовые знания
Оксиды - это соединения двух элементов, одним из которых является кислород в степени окисления -2. Общая формула оксидов: ЭmOn, где m - число атомов элемента Э; n - число атомов кислорода.
Все оксиды делятся на солеобразующие и несолеобразующие.
Несолеобразующие оксиды - это оксиды, которые не образуют солей при взаимодействии с кислотами и основаниями. Нужно запомнить четыре несолеобразующих оксида: CO, SiO, N2O, NO.
Солеобразующие оксиды - это оксиды, которые образуют соли при взаимодействии с кислотами и основаниями.
Все солеобразующие оксиды делятся на три типа:
1. Оснóвные оксиды - это оксиды, гидроксиды которых являются основаниями. Например: Na2O, ему соответствует основание NaOH.
2. Кислотные оксиды - это оксиды, гидроксиды которых являются кислотами. Например: SO3, ему соответствует кислота H2SO4.
3. Амфотерные оксиды - оксиды, которым соответствуют амфотерные гидроксиды. Например: Al2O3, ему соответствует амфотерный гидроксид Al(OH)3.
- Основные
Оксиды металлов в степени окисления +1 и +2 (за исключением ZnO, BeO):
Li2O, Na2O, K2O, CaO, MgO, RaO, SrO и другие.
- Амфотерные
Оксиды металлов в степени окисления +3 и +4, а также ZnO, BeO:
ZnO, BeO, Al2O3, Fe2O3, Cr2O3, MnO2, PbO2, SnO2 и другие.
- Кислотные
Оксиды металлов в степени окисления +5, +6, +7, а также оксиды всех неметаллов (кроме несолеобразующих CO, NO, N2O и SiO):
CO2, P2O5, SO2, SO3, NO2, CrO3 и многие другие.
Составляем формулы оксидов
Во всех оксидах степень окисления кислорода равна -2. Составляем формулу оксида так, чтобы суммарный заряд был равен 0. Например, у всех щелочных металлов степень окисления является постоянной и равна +1. Следовательно, нужно взять два атома щелочного металла, чтобы получить в сумме заряд +2 и вместе с кислородом (ст. ок. -2) суммарный заряд будет равен 0.
Можно пользоваться правилом креста. Пишем степени окисления элементов и переносим их крест-накрест, но соблюдаем несколько правил:
| 1. Индекс "1" не пишем: | 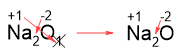 |
|
2. Одинаковые индексы в оксидах также не пишем: |
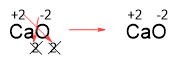 |
| 3. Чётные индексы сокращаем: |  |
В таблице ниже перечислены все оксиды, которые необходимо знать для ЕГЭ:
| Щелочные металлы: | Оксид ЭmOn | Степень окисления элемента Э | Тип оксида |
|---|---|---|---|
| Li | Li2O | +1 | оснóвный |
| Na | Na2O | +1 | оснóвный |
| K | K2O | +1 | оснóвный |
| Rb | Rb2O | +1 | оснóвный |
| Cs | Cs2O | +1 | оснóвный |
| Щелочно-земельные металлы: | |||
| Ca | CaO | +2 | оснóвный |
| Sr | SrO | +2 | оснóвный |
| Ba | BaO | +2 | оснóвный |
| Другие металлы: | |||
| Mg | MgO | +2 | оснóвный |
| Zn | ZnO | +2 | амфотерный |
| Be | BeO | +2 | амфотерный |
| Al | Al2O3 | +3 | амфотерный |
| Cr | CrO | +2 | оснóвный |
| Cr2O3 | +3 | амфотерный | |
| CrO3 | +6 | кислотный | |
| Fe | FeO | +2 | оснóвный |
| Fe2O3 | +3 | амфотерный | |
| Cu | Cu2O | +1 | оснóвный |
| CuO | +2 | оснóвный | |
| Mn | MnO2 | +4 | амфотерный |
| Неметаллы: | Оксид ЭmOn | Степень окисления элемента Э | Тип оксида |
|---|---|---|---|
| Cl | Cl2O | +1 | кислотный |
| Cl2O7 | +7 | кислотный | |
| S | SO2 | +4 | кислотный |
| SO3 | +6 | кислотный | |
| N | N2O | +1 | несолеобразующий |
| NO | +2 | несолеобразующий | |
| N2O3 | +3 | кислотный | |
| NO2 | +4 | кислотный | |
| N2O5 | +5 | кислотный | |
| P | P2O3 | +3 | кислотный |
| P2O5 | +5 | кислотный | |
| C | CO | +2 | несолеобразующий |
| CO2 | +4 | кислотный | |
| Si | SiO | +2 | несолеобразующий |
| SiO2 | +4 | кислотный |
Чтобы проверить свои знания, распечатайте эти таблицы (пустые) и заполните самостоятельно.
