ЕГЭ. Оксиды и гидроксиды неметаллов
Все солеобразующие оксиды неметаллов являются кислотными, и в качестве гидроксидов им соответствуют кислоты. К несолеобразующим оксидам относятся: N2O, NO, CO, SiO.
1. Оксиды и кислородсодержащие кислоты галогенов
В школьном курсе рассматриваются следующие степени окисления галогенов: +1, +3, +4, +5 и +7.
1) Оксиды хлора
Cl2O - оксид хлора (I) (желто-бурый газ), ему соответствует хлорноватистая кислота HClO (соли гипохлориты).
Cl2O3 - оксид в свободном виде не выделен.
Cl2O5 - оксид в свободном виде не выделен.
Cl2O7 - оксид хлора (VII) (бесцветная жидкость), ему соответствует хлорная кислота HClO4 (соли перхлораты).
ClO2 - оксид хлора (IV) (зеленовато-желтый газ), соответствующей кислоты нет.
2) Кислородсодержащие кислоты хлора, брома и йода
| Ст. Окисл. |
Cl | Br | I |
|---|---|---|---|
| +7 |
HClO4 - хлорная кислота |
HBrO4 - бромная кислота | HIO4 - метайодная к-та H5IO6 - ортоиодная к-та |
| +5 |
HClO3 - хлорноватая кислота |
HBrO3 - бромноватая кислота | HIO3 - йодноватая кислота |
| +3 |
HClO2 - хлористая кислота |
Кислота неустойчива | Кислота неустойчива |
| +1 | HClO - хлорноватистая кислота Слабая кислота, существует только в растворе |
HBrO - бромноватистая кислота | HIO - иодноватистая кислота |
Изображения некоторых рассматриваемых соединений:
| ClO2 | HClO | HClO4 |
|---|---|---|
 |
 |
 |
Названия солей кислородсодержащих солей хлора:
KClO4 - перхлорат калия
KClO3 - хлорат калия
KClO2 - хлорит калия
KClO - гипохлорит калия.
2. Оксиды и кислородсодержащие кислоты серы
В школьном курсе рассматриваются два оксида серы со степенями окисления серы +4 и +6:
SO2 - оксид серы (IV). Бесцветный газ с резким запахом. Ему соответствует слабая сернистая кислота H2SO3.
H2SO3 - сернистая кислота существует только в растворе, в свободном состоянии не выделена. Образуется при растворении диоксида серы в воде.
SO3 - оксид серы (VI). Легколетучая бесцветная жидкость с удушливым запахом. Ему соответствует сильная серная кислота H2SO4.
H2SO4 - бесцветная жидкость.
| SO3 | H2SO4 |
|---|---|
 |
 |
3. Оксиды и кислородсодержащие кислоты азота
Рассмотрим возможные степени окисления азота в соединениях: +1, +2, +3, +4, +5. Напомним, что максимальная валентность азота в соединениях равна IV.
| Ст. окисл. | Оксид | Кислота |
|---|---|---|
| +1 | N2O - несолеобразующий оксид. Бесцветный газ | - |
| +2 | NO - несолеобразующий оксид. Бесцветный газ | - |
| +3 | N2O3 - кислотный оксид (жидкость синего цвета при комнатной температуре) |
HNO2 - |
| +4 | NO2 - кислотный оксид (бурый газ) | - |
| +5 | N2O5 - кислотный оксид (бесцветные, очень летучие кристаллы) | HNO3 - сильная азотная кислота |
HNO2 - слабая неустойчивая кислота, существующая только в разбавленных водных растворах, окрашенных в слабый голубой цвет.
HNO3 - бесцветная жидкость с резким удушливым запахом. Концентрированная азотная кислота имеет бурую окраску вследствие происходящего на свету выделения бурого газа NO2.
|
N2O3 |
NO2 |
HNO2 |
HNO3 |
 |
 |
 |
 |
4. Оксиды и кислородсодержащие кислоты фосфора
Кислородсодержащие соединения фосфора содержат фосфор в степенях окисления +1, +3 или +5.
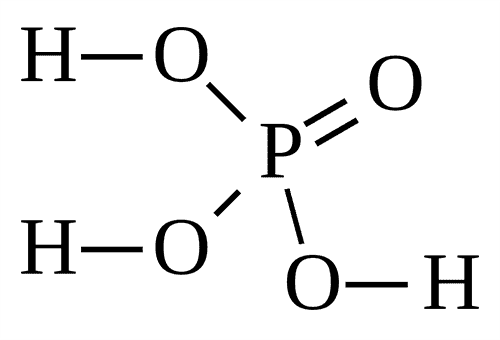
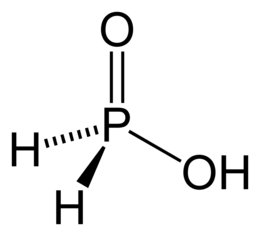
1) P2O3 - кислотный оксид, белые хлопья или кристаллы с неприятным запахом. Этому оксиду соответствует фосфористая кислота H3PO3.
H3PO3 - твёрдые бесцветные гигроскопичные кристаллы.
2) P2O5 - кислотный оксид, белый кристаллический порошок. Этому оксиду соответствует (орто)фосфорная кислота H3PO4.
H3PO4 - твёрдые бесцветные гигроскопичные кристаллы.
|
P2O3 |
H3PO3 |
P2O5 |
H3PO4 |
 |
 |
 |
 |
По словам составителей экзамена основность и строение кислот H3PO3 и H3PO2 на ЕГЭ проверяться не будет. Но они могут встретиться тестовой части, например, в задании 5, т.е. необходимо знать класс этих соединений (кислоты).
Такие кислоты, как фосфористая H3PO3 и фосфорноватистая H3PO2 образуют только соли, содержащие один и два атома водорода. Это происходит из-за того, что в этих кислотах есть атомы водорода, соединённые непосредственно с атомом фосфора, а они на металл не заменяются.
Например:
P4 + 3KOH + 3H2O -> PH3↑ + 3KH2PO2 (гипофосфит калия)
В таблице ниже представлены формулы и строение различных кислот фосфора.
|
Степень окисления P |
Формула кислоты |
Название кислоты |
Название солей |
Строение кислоты |
|---|---|---|---|---|
|
P+5 (V) |
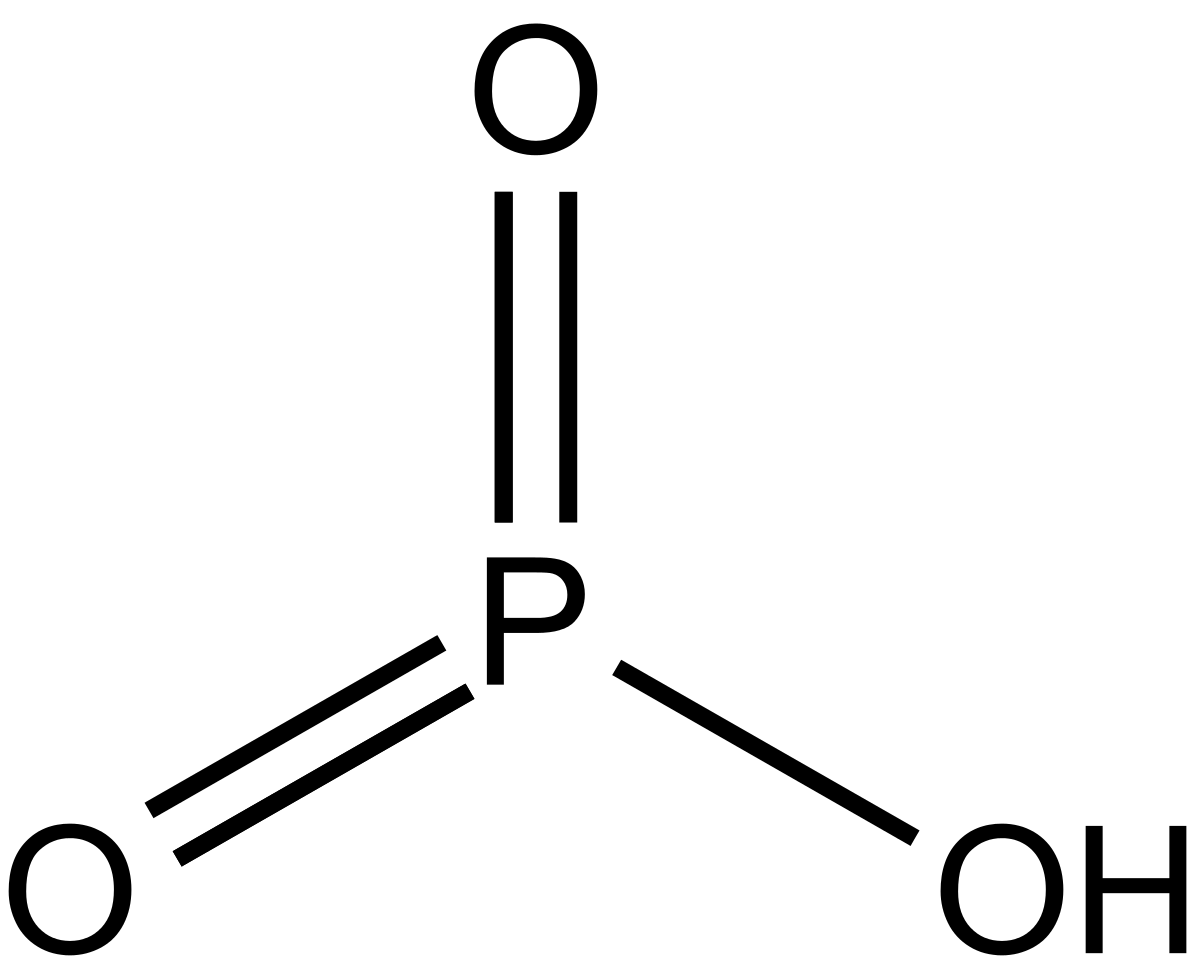
HPO3 |
Метафосфорная |
Метафосфаты, PO3– |
|
|
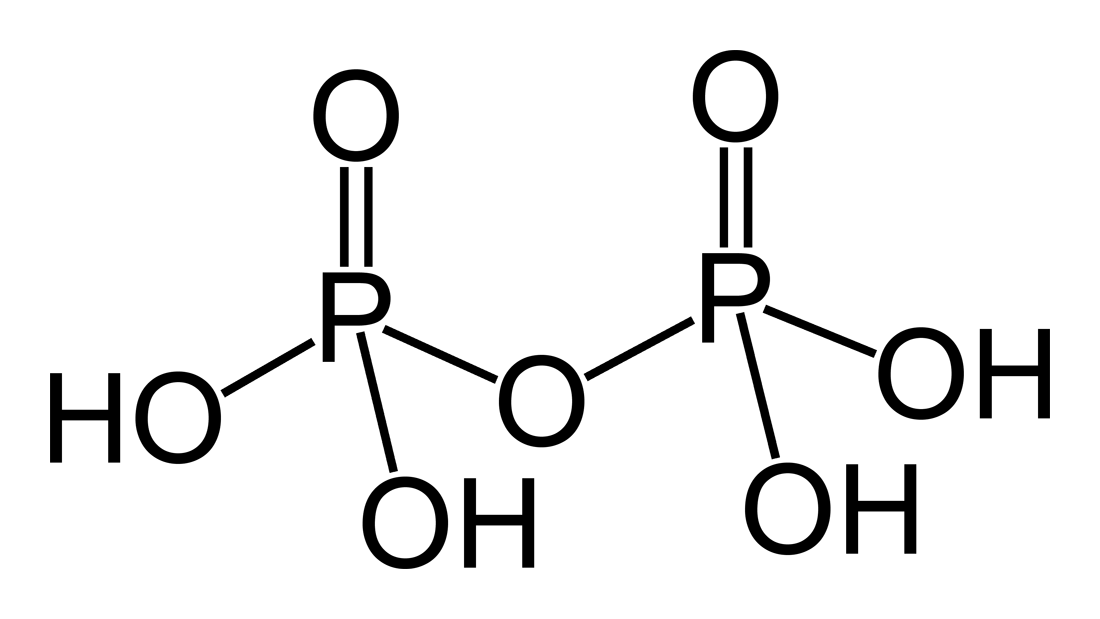
H4P2O7 |
Пирофосфорная |
Пирофосфаты, P2O74– |
|
|
|
H3PO4 |
Ортофосфорная |
(Орто)фосфаты, PO43– |
|
|
|
P+3 (V) |
H3PO3 |
Фосфористая (фосфоновая) |
Фосфиты, HPO32– (фосфонаты) |
|
|
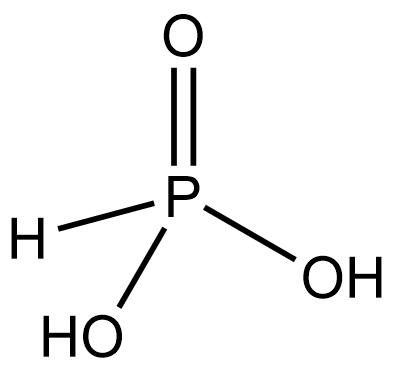
P+1 (V) |
H3PO2 |
Фосфорноватистая (фосфиновая) |
Гипофосфиты, H2PO2– (фосфинаты) |
|
5. Оксиды и кислородсодержащие кислоты углерода
1) CO - несолеобразующий оксид.
2) CO2 - кислотный оксид (бесцветный газ), которому соответствует слабая угольная кислота H2CO3.
H2CO3 образуется в малых количествах при растворении углекислого газа в воде. Существует только в растворах в равновесии с диоксидом углерода. При нормальных условиях равновесие сильно сдвинуто в сторону образования углекислого газа.
6. Оксиды и кислородсодержащие кислоты кремния
1) SiO - несолеобразующий оксид.
2) SiO2 - кислотный оксид (бесцветные кристаллы), которому соответствует слабая кремниевая кислота H2SiO3.
H2SiO3 в воде образует коллоидные растворы.
| SiO2 | H2SiO3 |
|---|---|
 |
 |