Металлический тип связи
Металлическая связь возникает в металлах и их сплавах за счет обобществления валентных электронов, которые слабо удерживаются ядром. В узлах кристаллической решетки находятся атомы и положительно заряженные ионы, а между ними находятся подвижные электроны:
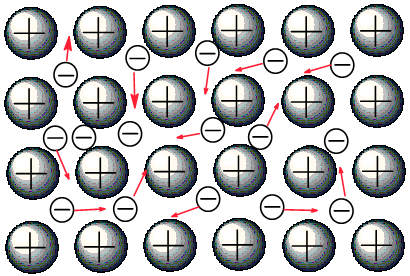
Очень красивая интерактивная 3D-анимация металлической связи показана на сайте www.labster.com.
Водородный тип связи
Водородная связь возникает между отрицательно заряженным атомом фтора, кислорода или азота и положительно заряженным атомом водорода. Данный тип связи обусловлен электростатическим притяжением разноимённых зарядов и может возникать как между молекулами, так и внутри одной молекулы.
Примером могут служить водородные связи между молекулами воды:
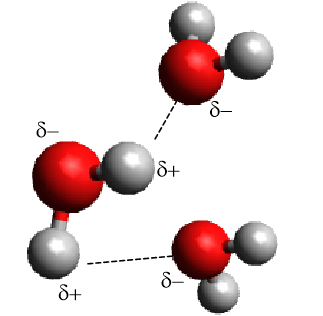
Соединения, между молекулами которых, образуется водородная связь:
1) H2O, NH3, HF
2) спирты (одноатомные, многоатомные)
3) карбоновые кислоты.
Важно помнить, что на атоме водорода должен быть частичный положительный заряд, который образуется, если водород непосредственно связан с фтором, кислородом или азотом. В этом случае более электроотрицательный атом оттягивает на себя электронную плотность от атома водорода, создавая на нем частичный положительный заряд.
В таких соединениях, как HI, SiH4, PH3, CH3COOCH3 (метиловый эфир уксусной кислоты), CH3COCH3 (ацетон), HCHO (формальдегид) водород не связан непосредственно с атомами фтора, кислорода или азота, поэтому водородные связи не образуются.
В тренировочных вариантах встречаются следующие соединения, между молекулами которых образуется водородная связь: NH3, CH3OH, HF, пропанол-2, глицерин, уксусная кислота, метановая кислота (муравьиная кислота) и др.
