Строение электронной оболочки атома
Для того, чтобы правильно выполнить первое задание экзамена, необходимо понимать, что означают такие понятия, как валентные электроны, внешние электроны, завершенный внешний электронный слой (или энергетический уровень) и "провал" электрона с s- на d-подуровень.
1. Внешние и валентные электроны
Внешние электроны - электроны, находящиеся на последнем (внешнем) энергетическом уровне.
Каждый период начинается щелочным металлом (кроме первого периода), в атомах которого на внешнем электронном слое имеется один s-электрон; электронное строение внешнего слоя - ns1 (n - номер периода).
Каждый период заканчивается инертным элементом. В атомах всех инертных элементов (кроме He) на внешнем электронном слое имеются два s- и шесть p-электронов; электронное строение внешнего слоя ns2np6 (n - номер периода).
Восемь электронов (электронный октет) - это максимальное число электронов на внешнем электронном слое атомов. Внешний электронный слой, который содержит 8 электронов, называется завершенным. Атомы инертных элементов имеют завершенный внешний электронный слой. Завершенной называется также электронная структура атома гелия He - 1s2. Атомы всех других элементов имеют незавершенные внешние электронные слои.
Валентные электроны - электроны, которые могут принимать участие в образовании химических связей. Для элементов главных подгрупп внешние электроны (т.е. s- и p-электроны) также являются и валентными. Для элементов побочных групп валентными являются внешние s- и предвнешние d-электроны.
Элементы главных подгрупп
1. Элементы 3Li, 11Na, 19K находятся в главной подгруппе I группы; их атомы имеют на внешнем слое 1 электрон:
| Элементы главной подгруппы I группы | Выделены внешние электроны, которые также являются и валентными |
|---|---|
| 3Li | 1s22s1 |
| 11Na | 1s22s22p63s1 |
| 19K | 1s22s22p63s23p64s1 |
2. Элементы 4Be, 12Mg, 20Ca находятся в главной подгруппе II группы; их атомы имеют на внешнем слое 2 электрона:
| Элементы главной подгруппы II группы | Выделены внешние электроны, которые также являются и валентными |
|---|---|
| 4Be | 1s22s2 |
| 12Mg | 1s22s22p63s2 |
| 20Ca | 1s22s22p63s23p64s2 |
3. Элементы 5B, 13Al, 31Ga находятся в главной подгруппе III группы; их атомы имеют на внешнем слое 3 электрона:
| Элементы главной подгруппы III группы | Выделены внешние электроны, которые также являются и валентными |
|---|---|
| 5B | 1s22s22p1 |
| 13Al | 1s22s22p63s23p1 |
| 31Ga | 1s22s22p63s23p64s23d104p1 |
4. Аналогично для элементов главной подгруппы VII группы; их атомы имеют на внешнем слое 7 электронов:
| Элементы главной подгруппы VII группы | Выделены внешние электроны, которые также являются и валентными |
|---|---|
| 9F* | 1s22s22p5 |
| 17Cl | 1s22s22p63s23p5 |
| 35Br | 1s22s22p63s23p64s23d104p5 |
F является исключением, так как может образовывать только одну звязь, а не 7.
Следовательно, число электронов на внешнем слое атомов элементов главных подгрупп (кроме He) равно номеру группы, в которой находятся элементы.
Поэтому главную подгруппу любой группы можно определить так:
Главная подгруппа - это вертикальный ряд элементов, атомы которых имеют одинаковое число электронов на внешнем электронном слое. Это число равно номеру группы.
4 электронных семейства элементов:
s-Элементы (элементы s-семейства) - это элементы, в атомах которых последним заполняется s-подуровень внешнего электронного слоя.
p-Элементы (элементы p-семейства) - это элементы, в атомах которых последним заполняется p-подуровень внешнего электронного слоя.
d-Элементы (элементы d-семейства) - это элементы, в атомах которых последним заполняется d-подуровень предвнешнего электронного слоя.
f-Элементы (элементы f-семейства) - это элементы, в атомах которых последним заполняется f-подуровень третьего снаружи электронного слоя.
Элементы побочных подгрупп
Побочная подгруппа - это вертикальный ряд d-элементов, которые имеют одинаковое суммарное число электронов на d-подуровне предвнешнего слоя и s-подуровне внешнего слоя. Это число обычно равно номеру группы.
Рассмотрим некоторые d-элементы 4-го периода
| d-Элементы 4-го периода | Выделены внешние s-электроны | Выделены валентные электроны (внешние s- и предвнещние d-электроны) |
|---|---|---|
| 21Sc | 1s22s22p63s23p64s23d1 | 1s22s22p63s23p64s23d1 |
| 22Ti | 1s22s22p63s23p64s23d2 | 1s22s22p63s23p64s23d2 |
| 23V | 1s22s22p63s23p64s23d3 | 1s22s22p63s23p64s23d3 |
| 24Cr (провал электрона) | 1s22s22p63s23p64s13d5 | 1s22s22p63s23p64s13d5 |
| 25Mn | 1s22s22p63s23p64s23d5 | 1s22s22p63s23p64s23d5 |
| 26Fe | 1s22s22p63s23p64s23d6 | 1s22s22p63s23p64s23d6 |
2. Провал электрона
Как можно видеть из данных таблицы, все d-элементы имеют один или два электрона на внешнем s-подуровне. В некоторых случаях происходит "провал" электрона с внешнего s- на предвнешний d-подуровень. Это связано с повышенной энергетической устойчивостью наполовину (d5) и полностью заполненных (d10) орбиталей. Провал электрона происходит в атомах таких элементов, как Cr и Cu (необходимо знать для ЕГЭ), а также в атомах Mo, Ag и Au.
Графически для атома меди провал электрона показан на следующем рисунке.
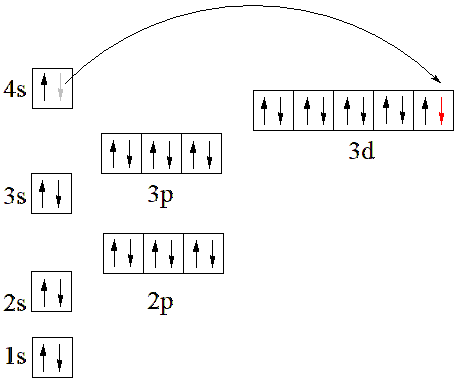
Электронная конфигурация атома меди: 1s22s22p63s23p64s13d10.
Литература:
1. Курс самоподготовки. А.А. Каверина и др. 2019 г.
2. Химия. Пособие-репетитор для поступающих в вузы. Под ред. проф. В.Н. Чернышова и доц. А.С. Егорова.
