ЕГЭ. Периодичность изменений свойств атомов. Электроотрицательность и радиус атома
Задания открытого банка ФИПИ на эту тему можно прорешать в данном уроке.
Изменение металлических и неметаллических свойств простых веществ рассматривается на другой странице. Там же рассматриваются кислотные и оснóвные свойства оксидов и гидроксидов.
Рассмотрим изменение электроотрицательности и радиуса атомов.
Электроотрицательность (ЭО) атома - способность атома притягивать к себе валентные электроны других атомов. Фтор является самым электроотрицательным из всех элементов со значением ЭО равным 4,0 (значения ЭО показаны в таблицах ниже под символами элементов).
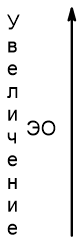
Как видно из таблицы, радиусы атомов сверху вниз увеличиваются, так как увеличивается число заполняемых электронных слоев. Вниз по группе внешние электроны находятся все дальше и дальше от ядра, притяжение к положительно заряженному ядру атома уменьшается, поэтому и уменьшается электроотрицательность, т.е. способность атомов принимать (притягивать) электроны.
| VI | VII | Электронные оболочки элементов VII группы |
Изменение |
Изменение ЭО |
|
| 2 | O 3,5 |
F 4,0 |
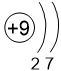 |
 |
 |
| 3 | S 2,5 |
Cl 3,0 |
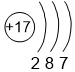 |
 |
|
| 4 | Se 2,4 |
Br 2,8 |
 |
 |
|
| 5 | Te 2,1 |
I 2,5 |
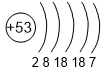 |
 |
Двигаясь вдоль периода слева направо электроны сильнее притягиваются к ядру, так как количество протонов в ядре также возрастает, радиус атома уменьшается. Благодаря этому возрастает способность атома притягивать к себе валентные электроны других атомов (т.е. ЭО) до получения завершенного энергетического уровня.
| I | II | III | IV | V | VI | VII | |
|
Электронные оболочки |
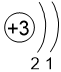 |
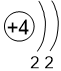 |
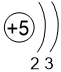 |
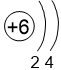 |
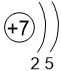 |
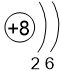 |
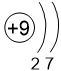 |
| 2 | Li 1,0 |
Be 1,5 |
B 2,0 |
C 2,5 |
N 3,0 |
O 3,5 |
F 4,0 |
| 3 | Na 0,9 |
Mg 1,2 |
Al 1,5 |
Si 1,8 |
P 2,1 |
S 2,5 |
Cl 3,0 |
| Изменение размера атомов |
 |
 |
 |
 |
 |
 |
 |
| Изменение электроотрицательности |  Увеличение электроотрицательности |
||||||
